Fehérjék – definíció, szerkezet, aminosavak és sejtfunkciók
Fehérjék: aminosavakból felépülő molekulák szerkezete, módosulásai és sejtfunkciói egy áttekintésben — értsd meg a biokémia alapjait!
A fehérjék hosszú láncú molekulák, amelyek aminosavaknak nevezett kis egységekből épülnek fel. Ezek peptidkötésekkel kapcsolódnak egymáshoz.
Ezek olyan biokémiai vegyületek, amelyek egy vagy több polipeptidből állnak, amelyek kerek vagy szálas alakba vannak hajtogatva.
A polipeptid aminosavak egyetlen lineáris polimerlánca. A polipeptidben lévő aminosavak szekvenciája egy gén DNS-szekvenciájából származik. A genetikai kód 20 standard aminosavat határoz meg. Röviddel a szintézis után néhány aminosavat kémiailag módosítanak. Ez megváltoztatja a fehérje összehajlását, stabilitását, aktivitását és funkcióját. Néha a fehérjékhez nem peptidcsoportok is kapcsolódnak, mint kofaktorok.
A fehérjék minden sejt számára nélkülözhetetlenek. Más biológiai makromolekulákhoz (poliszacharidok és nukleinsavak) hasonlóan a fehérjék is részt vesznek a sejtek gyakorlatilag minden folyamatában:
Fő sejtfunkciók
- Enzimatikus katalízis: sok fehérje enzimként működik, felgyorsítva a biokémiai reakciókat (pl. emésztőenzimek, metabolikus enzimek).
- Strukturális szerep: kollagén, keratin és más strukturális fehérjék adnak mechanikai szilárdságot szöveteknek és sejteknek.
- Transport: fehérjék szállítanak kis molekulákat és ionokat (pl. hemoglobin az oxigént szállítja, membrántranszporterek ionokat mozgatnak).
- Jelátvitel és receptorok: receptorfehérjék érzékelik a külső jeleket, és belső válaszokat indítanak el.
- Immunválasz: antitestek (immunglobulinok) felismerik és semlegesítik a kórokozókat.
- Kontrakció és mozgás: aktin és miozin részt vesznek az izomösszehúzódásban, valamint a sejtmotilitásban.
- Szabályozás: transzkripciós faktorok és más szabályozó fehérjék befolyásolják a génkifejeződést és a sejtműködést.
- Raktározás: egyes fehérjék tárolják a tápanyagokat vagy ionokat (pl. ferritin a vasat tárolja).
Szerkezet szintek
A fehérjék szerkezete több szinten írható le:
- Primer szerkezet: az aminosavak lineáris sorrendje (a peptidkötésekkel összekapcsolt lánc).
- Szekunder szerkezet: helyi hajtogatások, mint az α-hélix és β-lemez, amelyeket hidrogénkötések stabilizálnak.
- Tercier szerkezet: az egész polipeptid lánc térbeli elrendeződése, amely hidrofób kölcsönhatásokból, diszulfid-hidakból, ionos kötésekből és egyéb interakciókból tevődik össze.
- Kvaterner szerkezet: több polipeptidlánc (aláegység) összekapcsolódása működő komplexet alkotva (pl. hemoglobin négy aláegységből áll).
Aminosavak tulajdonságai
A 20 standard aminosav oldallánca (R-csoportja) határozza meg a fehérje kémiai tulajdonságait. Néhány fontos osztály:
- nem poláris, hidrofób aminosavak (pl. leucine, valine)
- poláris, semleges oldalláncú aminosavak (pl. serine, threonine)
- savanyú és bázikus (töltött) aminosavak (pl. aszparaginsav, lizine), amelyek ionkötéseket képezhetnek
- speciális aminosavak, mint a cisztin (diszulfid-hidak) vagy a prolin (hajtogatást befolyásoló)
Az aminosavak egy része esszenciális az ember számára, tehát táplálékkal kell felvenni őket.
Fehérjeszintézis és poszttranszlációs módosítások
A fehérjék szintézise a géntől a működő fehérjéig több lépésben történik: a gén transzkripciója során mRNS keletkezik, majd a riboszómák a transzláció során a kodonok alapján tRNS-ek segítségével kapcsolják össze az aminosavakat. A rögtön ezután bekövetkező poszttranszlációs módosítások (foszforiláció, glikoziláció, acetilezés, proteolízis, izomerizáció stb.) lényegesen befolyásolják a fehérjék funkcióját és lokalizációját. Egyes fehérjékhez nem fehérje természetű kofaktorok vagy koenzimek (pl. fémionok, vitamin-származékok) kapcsolódnak, amelyek nélkül nem működnek.
Hajtogatás, chaperonok és hibás összehajlás
A megfelelő térszerkezet kialakulását a sejtek chaperon fehérjéi segítik. Hibás hajtogatás aggregációhoz vezethet, ami bizonyos betegségek (például Alzheimer-kór, prionbetegségek) alapja lehet. A sejtek proteaszóma és lizoszóma rendszerei a hibás vagy elöregedett fehérjéket bontják le.
Membránfehérjék és lokalizáció
Sok fehérje célhelye a sejten belül vagy kívül meghatározott: egyesek a plazmamembránba ágyazódnak (transzmembrán fehérjék), mások sejtorganellumokba irányítódnak (pl. mitokondrium, endoplazmatikus retikulum), illetve kiválasztódnak a sejtből.
Stabilitás és denaturáció
A fehérjék szerkezete érzékeny a hőre, pH-ra, ionerősségre és detergensekre. A denaturáció során a másodlagos és harmadlagos szerkezet megszűnik, ami általában a funkció elvesztéséhez vezet. Bizonyos körülmények között a fehérje visszanyerheti eredeti szerkezetét, de gyakran irreverzibilis a károsodás.
Fehérjék vizsgálata
A fehérjék szerkezetét és funkcióját különböző módszerekkel tanulmányozzák:
- SDS-PAGE és Western blot – molekulatömeg és specifikus kimutatás
- Tömegspektrometria – fehérjeazonosítás és poszttranszlációs módosítások feltérképezése
- X-krisztallográfia, NMR és cryo-EM – 3D szerkezet meghatározása
- Enzimkinetikai mérések – katalitikus tulajdonságok vizsgálata
Példák és jelentőség
Néhány jól ismert fehérje: hemoglobin (oxigénszállítás), inzulin (hormonális szabályozás), kollagén (szöveti szerkezet), DNS-polimeráz (DNS replikáció), valamint az immunglobulinok (védőantitestek). A fehérjék kutatása alapvető az orvostudományban, biotechnológiában és ipari alkalmazásokban.
Evolúció és fehérjecsaládok
A fehérjék funkciói és szerkezetei gyakran konzerváltak evolúciósan: hasonló doméneket és motívumokat találunk különböző organizmusokban, ami lehetővé teszi a funkciók összehasonlítását és a bioinformatikai előrejelzést.
Összefoglalva, a fehérjék sokfélesége és sokoldalúsága miatt alapvető szereplők az élő rendszerekben: felépítenek szerkezeteket, katalizálnak reakciókat, közvetítik a kommunikációt és védelmet nyújtanak — minden sejt és szervezet működésének kulcsfontosságú elemei.
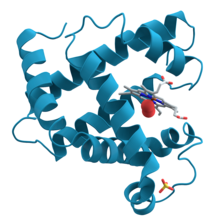
A myoglobin fehérje 3D-s diagramja, amely a türkizkék alfa-hélixeket mutatja. Ez a fehérje volt az első, amelynek szerkezetét röntgenkrisztallográfiával oldották meg. A tekercsek között jobbra-középen egy hemcsoport (szürke színnel ábrázolva) egy kötött oxigénmolekulával (piros).
Emberi fehérjék
A fehérjék alakjuktól függően különböző funkciókat látnak el. Megtalálhatók a húsban vagy az izomban. A növekedéshez és a javításhoz, valamint a csontok erősítéséhez használják őket. Segítenek a szövetek és sejtek létrehozásában. Az állatokban, növényekben, gombákban, baktériumokban és az emberi szervezetben is megtalálhatóak.
Az izmok sok fehérjét tartalmaznak. A fehérje emésztése során aminosavakra bomlik. Ezekből az aminosavakból aztán új fehérjéket lehet építeni. A fehérjék fontos részét képezik az olyan ételeknek, mint a tej, a tojás, a hús, a hal, a bab, a spenót és a diófélék. Négy tényező határozza meg, hogy egy fehérje mire képes. Az első az aminosavak sorrendje. Az aminosavaknak 20 különböző típusa létezik. A második a láncban lévő kis csavarok. A harmadik az, hogy az egész szerkezet hogyan van összehajtogatva. A negyedik, hogy különböző alegységekből áll-e. A hemoglobin molekulák például négy alegységből állnak.
Károsító mutációk
A legtöbb fehérje enzim, és a mutációk lelassíthatják vagy leállíthatják a működésüket. Az emberi rákos megbetegedések 50%-át a p53 tumorszupresszor mutációi okozzák. A p53 egy olyan fehérje, amely a sejtosztódást szabályozza.
Esszenciális aminosavak
A fehérjékre szükség van az állatok táplálékában, mivel az állatok nem képesek az összes szükséges aminosavat előállítani (a legtöbbet igen). Bizonyos aminosavakat a táplálékból kell beszerezniük. Ezeket nevezzük esszenciális aminosavaknak. Az emésztés során az állatok a bevitt fehérjét szabad aminosavakra bontják. Az aminosavakat ezután az anyagcsere során a szervezet számára szükséges enzimek és szerkezetek előállítására használják fel.
Az ember számára kilenc esszenciális aminosav létezik, amelyeket táplálékból nyerünk. A kilenc esszenciális aminosav a következő: hisztidin, izoleucin, leucin, lizin, metionin, fenilalanin, treonin, triptofán és valin. A hús tartalmazza az összes esszenciális aminosavat, amire az embernek szüksége van; a legtöbb növény nem. Azonban a növények keverékének fogyasztása, például a búza és a mogyoróvaj, vagy a rizs és a bab egyszerre, biztosítja az összes szükséges esszenciális aminosavat. A szójatermékek, mint például a tofu, az összes esszenciális aminosavat biztosítják - ahogy a quinoa is -, de nem ezek az egyetlen módja annak, hogy az embereknek szükséges fehérjéhez jussanak.
Jöns Jacob Berzelius tudós adta a fehérjéknek a nevet, de sok más tudós is tanulmányozta a fehérjéket.

A tojásfehérje sok fehérjét tartalmaz
Kapcsolódó oldalak
Kérdések és válaszok
K: Mik azok a fehérjék?
V: A fehérjék hosszú láncú molekulák, amelyek aminosavaknak nevezett kis egységekből épülnek fel.
K: Hogyan kapcsolódnak össze az aminosavak?
V: Az aminosavak peptidkötésekkel kapcsolódnak össze.
K: Mi az a polipeptid?
V: A polipeptid aminosavak egyetlen lineáris polimerlánca.
K: Honnan származik az aminosavak sorrendje egy polipeptidben?
V: A polipeptidben lévő aminosavak szekvenciája a gén DNS-szekvenciájából származik.
K: Mi történik röviddel a szintézis után néhány aminosavval?
V: Röviddel a szintézis után néhány aminosav kémiailag módosul.
K: Mit tesz a fehérjékben lévő aminosavak módosítása?
V: A fehérjékben lévő aminosavak módosulása megváltoztatja a fehérje összehajlását, stabilitását, aktivitását és működését.
K: Minden fehérje csak aminosavakból áll?
V: Nem, néha a fehérjékhez nem peptidcsoportok is kapcsolódnak, mint kofaktorok.
Keres