Hemoglobin: az oxigént szállító, vasat tartalmazó vörösvérsejt-fehérje
Fedezd fel a hemoglobint: a vasat tartalmazó vörösvérsejt-fehérjét, amely oxigént és szén-dioxidot szállít — működése, egészségügyi jelentősége és laborértékei egy helyen.
A hemoglobin (vagy hemoglobin) a vörösvértestek fehérjéje, amely vasat tartalmaz. Az emberi szervezetben elsősorban az oxigén szállítására szolgál: a tüdőben felveszi az oxigént, majd a szövetek felé továbbítja. A hemoglobin a fehérvérű halak kivételével minden gerinces állat vörösvérsejtjeiben megtalálható, és egyes gerinctelen állatokban is előfordul. Néhány más gerinctelen állat más vegyi anyagokat, például hemocianint használ az oxigénszállításhoz.
Szerkezete
A hemoglobin egy tetramer: négy fehérjeláncból (globinokból) áll, amelyekhez négy hemtömcs (porfirinváz + centrális vasatom) kapcsolódik. A felnőtt emberben a leggyakoribb formája az HbA, amely két alfa (α) és két béta (β) láncból áll (α2β2). Minden egyes hemtömcs egy Fe2+ vasatomot tartalmaz, amelyhez egy oxigénmolekula kapcsolódhat — így egy hemoglobinmolekula összesen négy oxigénmolekulát képes szállítani.
Működése és gázszállítás
A hemoglobin nemcsak az oxigént szállítja, hanem a szervezet légúti szén-dioxidjának egy részét is (kb. 20–25%). A szén-dioxid egy része hemoglobinhoz kötődve, karbaminoformában jut vissza a tüdőbe. Emellett a hemoglobin részt vesz a vér pH-jának szabályozásában is, mivel képes H+ ionokat megkötni és szállítani.
Az oxigénkötődés jellemzője a kooperativitás: amikor egy oxigénmolekula kötődik az egyik hez, a maradék hetek oxigénhez való affinitása megnő, így a kötődés görbéje szigmoid (S-alakú). Ez segíti a tüdőben a felvételt és a szövetekben a leadást. Az oxigénhez kötött hemoglobint gyakran oxihemoglobinnak nevezzük.
Speciális formák és kóros kötődések
A magzatok hemoglobinja (HbF) magasabb oxigénaffinitású, mint az anyai hemoglobin, ami előnyös az anyai magzati oxigénátvétel szempontjából. Léteznek további normál izoformák (például HbA2) és sok öröklött vagy szerzett eltérés: a szicklecellás betegségben egy pontmutáció miatt az egyik béta-láncban eltérés jön létre (HbS), a thalassaemiák pedig a globinláncok termelésének csökkenésével járnak.
Néhány anyag kórosan köti a hemoglobint: a szén-monoxid nagyon erősen kapcsolódik a hemoglobinhoz (carboxyhemoglobin képződik), ezért CO-mérgezésnél az oxigénszállítás hatékonysága súlyosan csökken. A hemoglobin vasatomának oxidációja (Fe2+ → Fe3+) methemoglobint hoz létre, amely nem képes oxigént kötni — ez is csökkentheti a szöveti oxigénellátást.
Élettani forgalom, szintézis és lebontás
A hemoglobin szintézise a csontvelőben zajlik, a vörösvértestek fejlődése (eritropoezis) során. A folyamathoz vasra, valamint megfelelő mennyiségű B12-vitaminra és folsavra van szükség. Egy egészséges vörösvértest élettartama körülbelül 120 nap; elöregedett vagy sérült sejtek a lépben és a májban bomlanak le. A hem leből bilirubin keletkezik (ami az epefestékek közé tartozik), a vas visszakerül a vasraktárakba és újrahasznosítható.
Klinikai jelentőség
A hemoglobin koncentrációja fontos laboratóriumi paraméter: teljes vérkép (CBC) részeként mérik. Tipikus referenciaértékek felnőttekben (könnyű eltérések laboronként):
- férfiak: kb. 13,8–17,2 g/dL
- nők: kb. 12,1–15,1 g/dL
Gyakoribb klinikai vizsgálatok és fogalmak: hematokrit (a vérsejtek térfogataránya), MCV, MCH, MCHC (a vörösvérsejtek méretére és hemoglobintartalmára vonatkozó mutatók). A pulzoximéter noninvazívan becsli az artériás oxigénszaturációt az oxi- és deoxihemoglobin fényelnyelési különbsége alapján.
Összefoglalás
A hemoglobin alapvető szerepet játszik az oxigén és részben a szén-dioxid szállításában, emellett a vér színét is a hemoglobin adja. Szerkezete és működése lehetővé teszi a hatékony gázcserét a tüdő és a szövetek között, miközben számos betegségi állapot (például anémia, hemoglobinopathiák, CO-mérgezés, methemoglobinémia) közvetlenül befolyásolja a szervezet oxigénellátását.
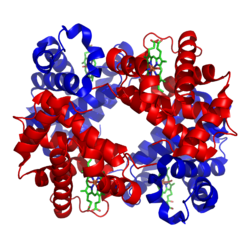
Az emberi hemoglobin szerkezete. Az α és β alegységek piros és kék színnel vannak jelölve. A vastartalmú hemcsoportok zölddel.
Szerkezet
Az emlősök leggyakoribb hemoglobintípusa négy ilyen alegységet tartalmaz. A hemoglobin minden alegysége egy gömb alakú fehérje (globin), amelynek belsejében egy hemcsoport található. Minden heme-csoportban egy vasatom található. Ez egy oxigénmolekulát köt meg. A teljes hemoglobinmolekulának tehát négy globinlánca, négy heme-molekulája és négy vasatomja van. Amikor a hemoglobin a tüdőben van, felveszi az oxigént a heme-molekulákba, és elszállítja a test többi részébe.
A szerkezetének kidolgozása évekig tartott. Max Perutz és John Kendrew dolgozta ki először a mioglobin szerkezetét. Ez az izomglobin kisebb, csak egy hemcsoporttal.
Kérdések és válaszok
K: Mi az a hemoglobin?
V: A hemoglobin a vörösvértestekben található fehérje, amely vasat tartalmaz, és az emberi testben az oxigén szállítására szolgál.
K: Hol található a hemoglobin?
V: A hemoglobin a fehérvérű halak kivételével minden gerinces állat vörösvérsejtjeiben megtalálható. Egyes gerinctelen állatokban is előfordul.
K: Mit használnak egyes gerinctelen állatok a hemoglobin helyett?
V: Néhány gerinctelen állat más vegyi anyagokat használ, például hemocianint.
K: Milyen más gázok szállításában vesz részt a hemoglobin?
V: A hemoglobin az oxigénen kívül más gázok szállításában is részt vesz. A szervezet légúti szén-dioxidjának egy részét (az összes szén-dioxid mintegy 20-25%-át) szállítja.
K: Mitől kapják a vörösvértestek a színüket?
V: A vörösvértestek a színüket a hemoglobintól kapják, amely piros.
K: Hány hemoglobinmolekula van minden egyes vörösvértestben?
V: Minden egyes vörösvértestben több millió hemoglobinmolekula van.
K: Hány vörösvértest van az emberi szervezetben?
V: Az emberi testben több millió vörösvértest van.
Keres