Mi az a molekula? Meghatározás, példák és szerkezet
Mi az a molekula? Meghatározás, példák és szerkezet – érthető magyarázat atomkötésekről, molekulaformulákról (pl. C6H12O6) és az anyagállapotok hatásáról.
A molekula egy kémiai anyag legkisebb létező mennyisége, amely megőrzi az adott anyag kémiai tulajdonságait. Ha egy molekulát kisebb darabokra bontanánk, azok az eredeti anyag kémiai viselkedését általában már nem mutatnák — kivéve bizonyos hálós szerkezetű anyagokat (pl. grafit vagy gyémánt), ahol a "darabolás" más szerkezeti formát eredményezne.
Az atomok és kötéseik
A molekulákat olyan atomok alkotják, amelyek egy adott alakban vagy formában kapcsolódnak egymáshoz. A kapcsolódás elsősorban kovalens kötések (elektron-pármegosztás) útján történik, de léteznek koordinatív kötésformák és bizonyos esetekben gyengébb kölcsönhatások is. Az atomok nem minden kombinációja egyformán lehetséges; bizonyos elemekre jellemző konfigurációk és valenciák határozzák meg, hogyan kapcsolódnak. Például általános szabályként:
- az oxigénatomok gyakran két kötést létesítenek más atomokkal,
- a szénatomok általában négy kötést hoznak létre,
- a nitrogénatomok tipikusan három kötést alakítanak ki.
Fontos megjegyezni, hogy ezek nem merev szabályok: vegyületekben előfordulhatnak töltésátadások, koordinált komplexek és ritkább kötési típusok is, amelyek eltérő kötésszámokat eredményeznek.
Molekula a gázok kinetikai elméletében
A gázok kinetikai elméletében a molekula kifejezést gyakran használják minden gázrészecskére, függetlenül annak összetételétől. E meghatározás szerint az egyatomos nemesgázok (például hélium, neon) is molekuláknak tekinthetők, mivel térben elkülöníthető részecskéket alkotnak — tehát egyatomos molekuláknak nevezzük őket a kinetikai szemléletben.
Molekulák és halmazállapotok
Az olyan gázokban, mint a levegő, a molekulák szabadon, nagy sebességgel mozognak és ritkán ütköznek össze. A folyadékokban, mint például a víz, a molekulák közelebb vannak egymáshoz, erősebb intermolekuláris erők (pl. hidrogénkötés, dipólus-dipólus kölcsönhatás, London-dispzixió) hatnak rájuk, ezért összetapadnak, de még mindig képesek elmozdulni. A szilárd anyagokban, mint a cukor, a molekulák általában csak rezegni tudnak a rácspontok körül; kivételek a hálószerkezetű kristályok (pl. gyémánt), ahol atomok alkotnak kiterjedt, nem diszkrét molekulákat. Az anyag negyedik, plazmának nevezett állapotában az atomok részben vagy teljesen ionizáltak, így nem képesek stabil, semleges molekulákat alkotni.
Molekulaképlet, szerkezeti képlet és moláris tömeg
A molekuláris képlet segítségével felírhatod a molekulában lévő összes atom számát. Például a glükóz molekulaformulája C6H12O6. Ez azt jelenti, hogy egy molekula glükóz hat szénatomból, tizenkét hidrogénatomból és hat oxigénatomból áll. A molekulaképlet nem ad információt arról, hogyan kapcsolódnak egymáshoz az atomok — erre szolgál a szerkezeti képlet vagy a kötésábrázolás (vonalas, Fischer-projekció, stb.).
A molekula tömegét úgy számítjuk ki, hogy összeadjuk az alkotó atomok tömegszámát (vagy pontosabban az atomok relatív atomtömegét), majd ezt moláris tömegként gramm/mol egységben adjuk meg. Ez fontos fizikai és kémiai számításoknál (pl. anyagmennyiség, oldatok koncentrációja).
Molekulaalak, polaritás és tulajdonságok
A molekulák alakját (geometriáját) a kötési szám és a kötést alkotó elektronpárok elhelyezkedése határozza meg; ezt a VSEPR-elmélet (elektronpárok térszerkezete) magyarázza. A molekula alakja döntő a fizikai és kémiai tulajdonságok szempontjából — például a víz (H2O) hajlított (bent) szerkezete miatt dipólusos, ami erős hidrogénkötésekhez és speciális oldószer-tulajdonságokhoz vezet.
Példák és különleges esetek
- Egyszerű molekulák: H2 (hidrogén), O2 (oxigén), N2 (nitrogén).
- Szén-dioxid: CO2 — lineáris molekula, gáz halmazállapotban.
- Víz: H2O — hajlított molekula, folyadéknál fontos a hidrogénkötés.
- Szenet tartalmazó molekulák: CH4 (metán) — tetraéderes elrendeződés.
- Ionicus sók, pl. NaCl — nem alkotnak egyszerű molekulákat, hanem ionrácsot; ezért a "molekula" kifejezést ilyen anyagokra általában nem használjuk.
- Nagy molekulák és makromolekulák: fehérjék, polimerek, DNS — ezek óriási számú atomból állnak és összetett szerkezetűek.
Extra megjegyzések
Vannak olyan kémiai részecskék, amelyek nem teljesen semleges, például gyökök (radikálisok) vagy ionok; ezek különleges reakcióképességgel rendelkeznek. A kémiai szakszavakat és modelleket (molekulapályák, kvantumkémia) tovább lehet finomítani, ha részletesebb elektronikus szerkezetre van szükség.
Összefoglalva: a molekula az a kémiai egység, amely az anyag tulajdonságait hordozza, és amelyet atomok kötései és térszerkezete határoz meg. A molekulák vizsgálata elengedhetetlen a kémia, a biokémia és a fizika számos területén.
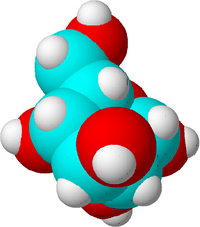
Ez egy cukormolekula. A szénatomok kékkel, az oxigénatomok pirossal, a hidrogénatomok pedig fehérrel vannak jelölve, hogy a különbséget érzékeltessük. A valóságban az atomoknak nincs színe.
Bonding
Ahhoz, hogy egy molekula létezzen, az atomoknak össze kell tapadniuk. Ez akkor történik, ha két atom megosztja egymással az elektronokat. Ahelyett, hogy csak egy atom körül keringene, az elektron most két atom körül kering. Ezt nevezzük kovalens kötésnek. Néha egynél több elektron is megosztásra kerül. Minél több elektront osztanak meg, annál erősebb lesz a kötés, és annál erősebben tapadnak egymáshoz az atomok.
A kötések is szétválhatnak. Mivel a legtöbb kötés kialakulásához energiára van szükség, a kötések felbontásakor is energiát adnak le. Mielőtt azonban a legtöbb kötés felszakadna, a molekulát fel kell melegíteni. Ekkor az atomok elkezdenek mozogni, és ha túl sokat mozognak, a kötés elszakad. Azokat a molekulákat, amelyeknek a felszakadásához kevesebb energiára van szükségük, mint amennyit felszakadáskor leadnak, üzemanyagoknak nevezzük. Egy gyertya például csak ül, és nem történik semmi. De ha gyufával meggyújtod, akkor sokáig égni fog. A gyufa hozza az energiát az első kötések felbontásához, amelyek elegendő energiát szabadítanak fel az alattuk lévő kötések felbontásához, amíg a gyertya le nem ég.
Vannak ionos kötések is.
Kérdések és válaszok
K: Mi az a molekula?
V: A molekula egy kémiai anyag lehető legkisebb mennyisége. Egymáshoz meghatározott alakban vagy formában kapcsolódó atomokból áll.
K: Hány kötésük van az oxigén, a szén és a nitrogén atomoknak?
V: Az oxigénatomoknak mindig két kötésük van más atomokkal, a szénatomoknak mindig négy kötésük van más atomokkal, a nitrogénatomoknak pedig mindig három kötésük van más atomokkal.
K: Mit mond a gázok kinetikai elmélete a molekulákról?
V: A gázok kinetikai elmélete szerint a molekula kifejezést gyakran használják minden gáznemű részecskére, függetlenül azok összetételétől. Ez azt jelenti, hogy a nemesgázatomokat molekuláknak tekintik, mivel valójában egyatomos molekulák.
K: Hogyan viselkednek a molekulák különböző állapotokban?
V: Az olyan gázokban, mint a levegő, a molekulák csak úgy repkednek. Az olyan folyadékokban, mint a víz, a molekulák összetapadnak, de még mindig képesek mozogni. Az olyan szilárd anyagokban, mint a cukor, a molekulák csak rezegni tudnak. A plazmában (az anyag negyedik állapotában) az atomok ionizáltak, és nem tudnak molekulákat alkotni.
K: Mi a molekuláris képlet?
V: A molekuláris képletet a molekulában lévő összes atom számának felírására használják. Például a C6H12O6 egy molekula glükózt jelent, amely hat szénatomból, tizenkét hidrogénatomból és hat oxigénatomból áll.
Keres