Enzim
Az enzimek olyan fehérjemolekulák a sejtekben, amelyek biológiai katalizátorként működnek. Az enzimek felgyorsítják a szervezetben zajló kémiai reakciókat, de nem használódnak el a folyamat során, ezért újra és újra felhasználhatók.
Az élőlényekben szinte minden biokémiai reakcióhoz enzimekre van szükség. Egy enzimmel a kémiai reakciók sokkal gyorsabban mennek végbe, mint az enzim nélkül.p39 Más biokatalizátorok a katalitikus RNS-molekulák, az úgynevezett ribozimek.
A reakció kezdetén lévő anyagokat szubsztrátoknak nevezzük. A reakció végén lévő anyagok a termékek. Az enzimek a szubsztrátokon dolgoznak, és azokat termékké alakítják. Az enzimek tanulmányozását nevezzük enzimológiának.
Az első enzimet 1833-ban Anselme Payen találta meg.
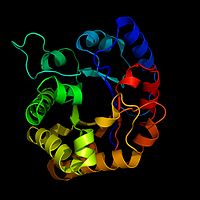
A TIM nevű enzim szalagdiagramja

A TIM nevű enzim szalagdiagramja
Az enzim szerkezete
Több ezer különböző enzim létezik, és mindegyik specifikus az általa katalizált reakcióra. Az enzimeknek olyan nevük van, amely megmutatja, hogy mit csinálnak. Az enzimnevek általában -áz végződéssel jelzik, hogy enzimről van szó. Ilyen például az ATP-szintáz. Egy ATP nevű vegyi anyagot állít elő. Egy másik példa a DNS-polimeráz. Egy ép DNS-szálat olvas be, és sablonként használja fel egy új DNS-szál létrehozásához.Az enzimre példa az amiláz, amely a nyálban található. A keményítőmolekulákat kisebb glükóz- és maltózmolekulákra bontja. Egy másik enzimfajta a lipáz. A zsírokat kisebb molekulákra, zsírsavakra és glicerinre bontja.d
A proteázok az enzimek egy egész osztályát alkotják. Más enzimeket és fehérjéket bontanak vissza aminosavakká. A nukleázok olyan enzimek, amelyek a DNS-t vagy az RNS-t vágják, gyakran a molekula meghatározott helyén.
Az enzimek nem csak arra szolgálnak, hogy a nagyméretű vegyi anyagokat kisebb vegyszerekre bontják. Más enzimek kisebb vegyi anyagokat vesznek fel, és nagyobb vegyi anyagokká építik fel őket, és számos más kémiai feladatot is ellátnak. Az alábbi osztályozás a főbb típusokat sorolja fel.
A biokémikusok gyakran rajzolnak egy képet egy enzimről, hogy vizuális segédletként vagy térképként használhassák az enzim működését. Ez azért nehéz, mert egy enzimben több száz vagy ezer atom is lehet. A biokémikusok nem tudják lerajzolni ezt a sok részletet. Ehelyett szalagmodelleket használnak az enzimek képeként. A szalagmodellek megmutatják az enzim alakját anélkül, hogy minden atomot le kellene rajzolni.
A legtöbb enzim csak akkor működik, ha a hőmérséklet és a pH megfelelő. Emlősöknél a megfelelő hőmérséklet általában 37Co fok (testhőmérséklet). A megfelelő pH-érték nagymértékben változhat. A pepszin egy példa arra az enzimre, amely akkor működik a legjobban, ha a pH körülbelül 1,5.
Az enzim bizonyos hőmérséklet fölé történő melegítése véglegesen elpusztítja az enzimet. A proteáz lebontja, és a vegyi anyagokat újra felhasználják.
Egyes vegyi anyagok segíthetnek egy enzimnek még jobban elvégezni a munkáját. Ezeket nevezzük aktivátoroknak. Néha egy vegyi anyag lelassíthatja az enzimet, vagy akár arra is képes, hogy az enzim egyáltalán ne működjön. Ezeket nevezzük inhibitoroknak. A legtöbb gyógyszer olyan vegyi anyag, amely vagy felgyorsít vagy lelassít valamilyen enzimet az emberi szervezetben.
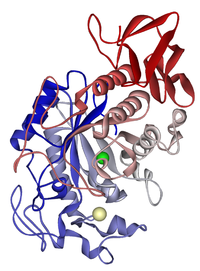
Nyálamiláz: kloridion zöld; kalcium bézs színű
Az enzim szerkezete
Több ezer különböző enzim létezik, és mindegyik specifikus az általa katalizált reakcióra. Az enzimeknek olyan nevük van, amely megmutatja, hogy mit csinálnak. Az enzimnevek általában -áz végződéssel jelzik, hogy enzimről van szó. Ilyen például az ATP-szintáz. Egy ATP nevű vegyi anyagot állít elő. Egy másik példa a DNS-polimeráz. Egy ép DNS-szálat olvas be, és sablonként használja fel egy új DNS-szál létrehozásához.Az enzimre példa az amiláz, amely a nyálban található. A keményítőmolekulákat kisebb glükóz- és maltózmolekulákra bontja. Egy másik enzimfajta a lipáz. A zsírokat kisebb molekulákra, zsírsavakra és glicerinre bontja.d
A proteázok az enzimek egy egész osztályát alkotják. Más enzimeket és fehérjéket bontanak vissza aminosavakká. A nukleázok olyan enzimek, amelyek a DNS-t vagy az RNS-t vágják, gyakran a molekula meghatározott helyén.
Az enzimek nem csak arra szolgálnak, hogy a nagyméretű vegyi anyagokat kisebb vegyszerekre bontják. Más enzimek kisebb vegyi anyagokat vesznek fel, és nagyobb vegyi anyagokká építik fel őket, és számos más kémiai feladatot is ellátnak. Az alábbi osztályozás a főbb típusokat sorolja fel.
A biokémikusok gyakran rajzolnak egy képet egy enzimről, hogy vizuális segédletként vagy térképként használhassák az enzim működését. Ez azért nehéz, mert egy enzimben több száz vagy ezer atom is lehet. A biokémikusok nem tudják lerajzolni ezt a sok részletet. Ehelyett szalagmodelleket használnak az enzimek képeként. A szalagmodellek megmutatják az enzim alakját anélkül, hogy minden atomot le kellene rajzolni.
A legtöbb enzim csak akkor működik, ha a hőmérséklet és a pH megfelelő. Emlősöknél a megfelelő hőmérséklet általában 37Co fok (testhőmérséklet). A megfelelő pH-érték nagymértékben változhat. A pepszin egy példa arra az enzimre, amely akkor működik a legjobban, ha a pH körülbelül 1,5.
Az enzim bizonyos hőmérséklet fölé történő melegítése véglegesen elpusztítja az enzimet. A proteáz lebontja, és a vegyi anyagokat újra felhasználják.
Egyes vegyi anyagok segíthetnek egy enzimnek még jobban elvégezni a munkáját. Ezeket nevezzük aktivátoroknak. Néha egy vegyi anyag lelassíthatja az enzimet, vagy akár arra is képes, hogy az enzim egyáltalán ne működjön. Ezeket nevezzük inhibitoroknak. A legtöbb gyógyszer olyan vegyi anyag, amely vagy felgyorsít vagy lelassít valamilyen enzimet az emberi szervezetben.

Nyálamiláz: kloridion zöld; kalcium bézs színű
Zár és kulcs modell
Az enzimek nagyon specifikusak. Emil Fischer 1894-ben felvetette, hogy mind az enzimnek, mind a szubsztrátnak sajátos, egymást kiegészítő geometriai formái vannak, amelyek pontosan illeszkednek egymáshoz. Ezt gyakran "zár és kulcs" modellként emlegetik. Ez a modell azonban nem magyarázza meg, hogy mi történik ezután.1958-ban Daniel Koshland a zár és kulcs modell módosítását javasolta. Mivel az enzimek meglehetősen rugalmas szerkezetek, az aktív központot a szubsztráttal való kölcsönhatások alakítják át. Ennek eredményeként a szubsztrát nem egyszerűen egy merev aktív helyhez kötődik. Az aktív hely aminosav-oldalláncai olyan helyzetekbe hajlítódnak, hogy az enzim elvégezze katalitikus munkáját. Egyes esetekben, például a glikozidázok esetében a szubsztrátmolekula is kissé megváltoztatja alakját, ahogy belép az aktív centrumba.
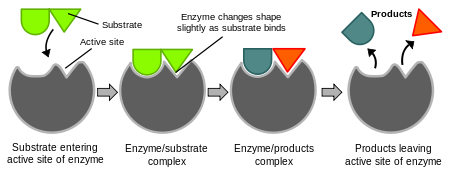
Az enzimhatás indukált illeszkedési hipotézisét bemutató diagramok
Zár és kulcs modell
Az enzimek nagyon specifikusak. Emil Fischer 1894-ben felvetette, hogy mind az enzimnek, mind a szubsztrátnak sajátos, egymást kiegészítő geometriai formái vannak, amelyek pontosan illeszkednek egymáshoz. Ezt gyakran "zár és kulcs" modellként emlegetik. Ez a modell azonban nem magyarázza meg, hogy mi történik ezután.1958-ban Daniel Koshland a zár és kulcs modell módosítását javasolta. Mivel az enzimek meglehetősen rugalmas szerkezetek, az aktív központot a szubsztráttal való kölcsönhatások alakítják át. Ennek eredményeként a szubsztrát nem egyszerűen egy merev aktív helyhez kötődik. Az aktív hely aminosav-oldalláncai olyan helyzetekbe hajlítódnak, hogy az enzim elvégezze katalitikus munkáját. Egyes esetekben, például a glikozidázok esetében a szubsztrátmolekula is kissé megváltoztatja alakját, ahogy belép az aktív centrumba.

Az enzimhatás indukált illeszkedési hipotézisét bemutató diagramok
Funkció
Az enzimreakció általános egyenlete a következő:
Szubsztrát + enzim -> Szubsztrát:enzim -> Termék:enzim -> Termék + enzim
Az enzimek csökkentik a reakció aktiválási energiáját azáltal, hogy a szubsztráttal köztes komplexet képeznek. Ezt a komplexet enzim-szubsztrát komplexnek nevezzük.
Például a szukráz, amely 400-szor nagyobb, mint a szubsztrátja, a szacharózt az alkotócukra, a glükózra és a fruktózra bontja. A szukráz meghajlítja a szacharózt, és feszíti a glükóz és a fruktóz közötti kötést. A vízmolekulák csatlakoznak és a másodperc tört része alatt végzik el a hasadást. Az enzimek a következő kulcsfontosságú tulajdonságokkal rendelkeznek:
- Ezek katalizátorok. Általában 10 milliárdszorosára növelik a reakció sebességét.p39 Maga az enzim nem változik a reakció során.
- Apró mennyiségben is hatékonyak. Egy enzimmolekula percenként 1000 molekula szubsztrátot alakíthat át, egyes enzimek pedig 3 millió molekulát képesek egy perc alatt átalakítani.p39
- Rendkívül specifikusak. Egy enzim csak egyet hajt végre a számos reakció közül, amelyre egy szubsztrát képes.
Az enzimaktivitás ellenőrzése
Az enzimek aktivitását a sejtben öt fő módon szabályozzák.
- Az enzimtermelés (az enzimgének transzkripciója és transzlációja) a sejt környezetében bekövetkező változásokra reagálva növelhető vagy csökkenthető. A génszabályozásnak ezt a formáját enzimindukciónak és -gátlásnak nevezzük. Például az antibiotikumokkal, például a penicillinnel szemben rezisztens baktériumokban olyan enzimek indukálódnak, amelyek hidrolizálják a penicillin molekulát.
- Az enzimek különböző sejtkompartmentekben fordulhatnak elő. Például a zsírsavakat egy enzimkészlet szintetizálja a citoszolban, az endoplazmatikus retikulumban és a Golgi-apparátusban. Ezután egy másik enzimkészlet használja fel őket energiaforrásként a mitokondriumokban.
- Az enzimek saját termékeikkel szabályozhatók. Például a végtermék(ek) gyakran gátolják az útvonal egyik első enzimjét. Az ilyen szabályozási mechanizmust negatív visszacsatolásnak nevezzük, mivel a keletkező végtermék mennyiségét a saját koncentrációja szabályozza. Ez megakadályozza, hogy a sejtek túl sok enzimet termeljenek. Az enzimműködés szabályozása segít az élő szervezetekben a belső környezet stabilitásának fenntartásában.
- Az enzimeket úgy lehet szabályozni, hogy előállításuk után módosítják őket. Erre példa a polipeptidlánc hasítása. A kimotripszin, egy emésztést elősegítő proteáz, inaktív formában termelődik a hasnyálmirigyben, és ebben a formában szállítják a gyomorba, ahol aktiválódik. Ez megakadályozza, hogy az enzim megeméssze a hasnyálmirigyet vagy más szöveteket, mielőtt a bélbe kerülne. Az enzim ilyen típusú inaktív előfutárát zimogénnek nevezik.
- Egyes enzimek aktiválódhatnak, ha más környezetbe kerülnek (pl. magas pH-értékről alacsony pH-értékre). Például az influenzavírusban lévő haemagglutinin az alakváltozástól aktiválódik. Ezt a gazdasejt lizoszómájában kialakuló savas körülmények okozzák.
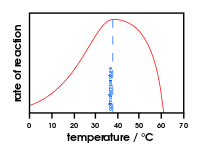
A hőmérséklet változásának az enzimaktivitásra gyakorolt hatását bemutató ábra
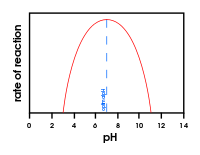
A pH-érték változásának az enzimaktivitásra gyakorolt hatását bemutató ábra
Funkció
Az enzimreakció általános egyenlete a következő:
Szubsztrát + enzim -> Szubsztrát:enzim -> Termék:enzim -> Termék + enzim
Az enzimek csökkentik a reakció aktiválási energiáját azáltal, hogy a szubsztráttal köztes komplexet képeznek. Ezt a komplexet enzim-szubsztrát komplexnek nevezzük.
Például a szukráz, amely 400-szor nagyobb, mint a szubsztrátja, a szacharózt az alkotócukra, a glükózra és a fruktózra bontja. A szukráz meghajlítja a szacharózt, és feszíti a glükóz és a fruktóz közötti kötést. A vízmolekulák csatlakoznak és a másodperc tört része alatt végzik el a hasadást. Az enzimek a következő kulcsfontosságú tulajdonságokkal rendelkeznek:
- Ezek katalizátorok. Általában 10 milliárdszorosára növelik a reakció sebességét.p39 Maga az enzim nem változik a reakció során.
- Apró mennyiségben is hatékonyak. Egy enzimmolekula percenként 1000 molekula szubsztrátot alakíthat át, egyes enzimek pedig 3 millió molekulát képesek egy perc alatt átalakítani.p39
- Rendkívül specifikusak. Egy enzim csak egyet hajt végre a számos reakció közül, amelyre egy szubsztrát képes.
Az enzimaktivitás ellenőrzése
Az enzimek aktivitását a sejtben öt fő módon szabályozzák.
- Az enzimtermelés (az enzimgének transzkripciója és transzlációja) a sejt környezetében bekövetkező változásokra reagálva növelhető vagy csökkenthető. A génszabályozásnak ezt a formáját enzimindukciónak és -gátlásnak nevezzük. Például az antibiotikumokkal, például a penicillinnel szemben rezisztens baktériumokban olyan enzimek indukálódnak, amelyek hidrolizálják a penicillin molekulát.
- Az enzimek különböző sejtkompartmentekben fordulhatnak elő. Például a zsírsavakat egy enzimkészlet szintetizálja a citoszolban, az endoplazmatikus retikulumban és a Golgi-apparátusban. Ezután egy másik enzimkészlet használja fel őket energiaforrásként a mitokondriumokban.
- Az enzimek saját termékeikkel szabályozhatók. Például a végtermék(ek) gyakran gátolják az útvonal egyik első enzimjét. Az ilyen szabályozási mechanizmust negatív visszacsatolásnak nevezzük, mivel a keletkező végtermék mennyiségét a saját koncentrációja szabályozza. Ez megakadályozza, hogy a sejtek túl sok enzimet termeljenek. Az enzimműködés szabályozása segít az élő szervezetekben a belső környezet stabilitásának fenntartásában.
- Az enzimeket úgy lehet szabályozni, hogy előállításuk után módosítják őket. Erre példa a polipeptidlánc hasítása. A kimotripszin, egy emésztést elősegítő proteáz, inaktív formában termelődik a hasnyálmirigyben, és ebben a formában szállítják a gyomorba, ahol aktiválódik. Ez megakadályozza, hogy az enzim megeméssze a hasnyálmirigyet vagy más szöveteket, mielőtt a bélbe kerülne. Az enzim ilyen típusú inaktív előfutárát zimogénnek nevezik.
- Egyes enzimek aktiválódhatnak, ha más környezetbe kerülnek (pl. magas pH-értékről alacsony pH-értékre). Például az influenzavírusban lévő haemagglutinin az alakváltozástól aktiválódik. Ezt a gazdasejt lizoszómájában kialakuló savas körülmények okozzák.

A hőmérséklet változásának az enzimaktivitásra gyakorolt hatását bemutató ábra

A pH-érték változásának az enzimaktivitásra gyakorolt hatását bemutató ábra
Enzimgátlók
Az inhibitorok arra használhatók, hogy megakadályozzák az enzim szubsztráthoz való kötődését. Ez egy enzim által vezérelt reakció lelassítására szolgálhat. Az inhibitorok lazán vagy részben illeszkednek az enzim aktív helyére. Ez megakadályozza vagy lelassítja az enzim-szubsztrát komplex kialakulását.
Enzimgátlók
Az inhibitorok arra használhatók, hogy megakadályozzák az enzim szubsztráthoz való kötődését. Ez egy enzim által vezérelt reakció lelassítására szolgálhat. Az inhibitorok lazán vagy részben illeszkednek az enzim aktív helyére. Ez megakadályozza vagy lelassítja az enzim-szubsztrát komplex kialakulását.
Denaturáció
A denaturáció az enzim aktív helyének visszafordíthatatlan megváltozása, amelyet a hőmérséklet vagy a pH szélsőséges változása okoz. Ez csökkenti a reakció sebességét, mivel a szubsztrátmolekula nem tud beilleszkedni az aktív helyre, így nem tudnak termékek képződni.
Denaturáció
A denaturáció az enzim aktív helyének visszafordíthatatlan megváltozása, amelyet a hőmérséklet vagy a pH szélsőséges változása okoz. Ez csökkenti a reakció sebességét, mivel a szubsztrátmolekula nem tud beilleszkedni az aktív helyre, így nem tudnak termékek képződni.
Cofaktorok
A kofaktorok vagy koenzimek olyan segédmolekulák, amelyek egy enzim működéséhez szükségesek. Ezek nem fehérjék, és lehetnek szerves vagy szervetlen molekulák. Mindkét molekulatípus középpontjában néha fémion áll, például Mg2+, Cu2+, Mn2+ vagy vas-kén klaszterek. Ennek oka, hogy az ilyen ionok elektrondonorként működhetnek, és ez számos reakcióban fontos. Az enzimek különböző kis segítőkre való igénye az alapvető oka annak, hogy az állatoknak, így nekünk is, nyomelemekre és vitaminokra van szükségünk.
Kofaktorok
A kofaktorok vagy koenzimek olyan segédmolekulák, amelyek egy enzim működéséhez szükségesek. Ezek nem fehérjék, és lehetnek szerves vagy szervetlen molekulák. Mindkét molekulatípus középpontjában néha fémion áll, például Mg2+, Cu2+, Mn2+ vagy vas-kén klaszterek. Ennek oka, hogy az ilyen ionok elektrondonorként működhetnek, és ez számos reakcióban fontos. Az enzimek különböző kis segítőkre való igénye az alapvető oka annak, hogy az állatoknak, így nekünk is, nyomelemekre és vitaminokra van szükségünk.
Osztályozás
Az enzimeket a Nemzetközi Biokémiai Unió osztályozta. Az enzimekkel foglalkozó bizottságuk az összes ismert enzimet hat osztályba sorolta:
- Oxido-reduktázok: katalizálják az elektronok átadását.
- Transzferázok: funkciós csoportot mozgatnak át egyik molekuláról a másikra.
- Hidrolázok: -OH (hidroxil) csoport hozzáadása
- Lázok: kémiai kötéseket hasítanak, és gyakran kettős kötést vagy gyűrűszerkezetet adnak hozzá.
- Izomerázok: A -> B, ahol B az A izomerje
- Ligázok: két nagy molekulát kötnek össze: Ab + C -> A-C + b
Az egyes enzimek négyjegyű számot kapnak, amely az adatbázisban osztályozza őket. p145
Osztályozás
Az enzimeket a Nemzetközi Biokémiai Unió osztályozta. Az enzimekkel foglalkozó bizottságuk az összes ismert enzimet hat osztályba sorolta:
- Oxido-reduktázok: katalizálják az elektronok átadását.
- Transzferázok: funkciós csoportot mozgatnak át egyik molekuláról a másikra.
- Hidrolázok: -OH (hidroxil) csoport hozzáadása
- Lázok: kémiai kötéseket hasítanak fel, és gyakran kettős kötést vagy gyűrűszerkezetet adnak hozzá.
- Izomerázok: A -> B, ahol B az A izomerje
- Ligázok: két nagy molekulát kötnek össze: Ab + C -> A-C + b
Az egyes enzimek négyjegyű számot kapnak, amely az adatbázisban osztályozza őket. p145
Az enzimek felhasználása
Az enzimeket a kereskedelemben a következőkre használják:
- bébiétel készítése - előemésztett ételek csecsemőknek
- a csokoládék közepének megpuhítása
- biológiai mosópor - amely proteáz enzimeket tartalmaz a szennyeződések lebontására. A nagy, oldhatatlan molekulákat apró, oldható molekulákra bontja. Alacsonyabb hőmérsékleten működik, így kevesebb energiára van szükség (termosztálható).
Az enzimek felhasználása
Az enzimeket a kereskedelemben a következőkre használják:
- bébiétel készítése - előemésztett ételek csecsemőknek
- a csokoládék közepének megpuhítása
- biológiai mosópor - amely proteáz enzimeket tartalmaz a szennyeződések lebontására. A nagy, oldhatatlan molekulákat apró, oldható molekulákra bontja. Alacsonyabb hőmérsékleten működik, így kevesebb energiára van szükség (termosztálható).
Kapcsolódó oldalak
- Burst kinetika
Kapcsolódó oldalak
- Burst kinetika
Kérdések és válaszok
K: Mi az az enzim?
V: Az enzim a sejtekben található fehérjemolekula, amely biológiai katalizátorként működik.
K: Mi a feladata az enzimeknek a szervezetben?
V: Az enzimek felgyorsítják a kémiai reakciókat a szervezetben, de nem használódnak el a folyamat során, így újra és újra felhasználhatók.
K: Az élőlényekben minden biokémiai reakcióhoz enzimekre van szükség?
V: Igen, az élőlényekben szinte minden biokémiai reakcióhoz enzimekre van szükség.
K: Mik azok a szubsztrátok?
V: A szubsztrátok azok az anyagok, amelyek a reakció kezdetén állnak.
K: Mik a termékek?
V: A termékek a reakció végén lévő anyagok.
K: Hogyan nevezik az enzimek tanulmányozását?
V: Az enzimek tanulmányozását enzimológiának nevezzük.
K: Ki fedezte fel az első enzimet?
V: Az első enzimet 1833-ban Anselme Payen fedezte fel.
Keres