Mi az a kémiai reakció? Meghatározás, típusok és példák
Mi az a kémiai reakció? Meghatározás, típusok és példák — egyszerű magyarázatok és mindennapi példák (rozsda, ecet+sóda, égés), exoterm/endoterm folyamatok áttekintése.
Kémiai reakció akkor következik be, amikor egy vagy több vegyi anyag egy vagy több más vegyi anyaggá alakul át. Példák:
- a vas és az oxigén összekapcsolódása rozsdává válik
- ecet és szódabikarbóna egyesülése nátrium-acetát, szén-dioxid és víz előállítására.
- égő vagy felrobbanó dolgok
- számos reakció, amely az élőlények belsejében zajlik
- elektrokémiai reakciók az akkumulátorok kisütésekor vagy újratöltésekor
A kémiai reakciók lényege, hogy atomok közötti kötéseket megszakítanak és új kötéseket hoznak létre, így alakulnak át a kiindulási anyagok (reaktánsok) a végtermékekké (termékek). A reakciók során érvényesül az anyagmegmaradás törvénye: az atomok száma és fajtája a reakció előtt és után összességében ugyanaz marad, csak más elrendezésben találhatók meg. A reakciók leírhatók kémiai egyenletekkel, például egy egyszerű égés (metán égése): CH4 + 2 O2 → CO2 + 2 H2O.
Típusok és gyakori példák
A kémiai reakciókat több szempont szerint csoportosíthatjuk. Néhány gyakori típus:
- Szintézis (egyesülés): két vagy több anyag egyetlen terméket képez (A + B → AB). Példa: hidrogén és oxigén vízzé egyesülése 2 H2 + O2 → 2 H2O.
- Dezintegráció (bomlás): egy anyag több egyszerűbb anyagra bomlik (AB → A + B). Példa: víz elektrolízise H2O → H2 + 1/2 O2.
- Egyszerű cserereakció (helyettesítés): egy elem kicseréli helyét egy másik elemmel egy vegyületben (A + BC → AC + B).
- Kettős helyettesítés: két vegyület ionjai cserélődnek (AB + CD → AD + CB), gyakori csapadékképződésnél vagy sav-bázis reakcióknál.
- Égés (combustion): általában oxigénnel való gyors reakció, amely hőt és füstgázokat (pl. CO2, H2O) ad le.
- Redox (oxidáció‑redukció): elektronátvitel történik; sok fontos folyamat, például a elektrokémiai reakciók és a akkumulátorok működése ilyen.
- Sav‑bázis reakciók: protonátadás történik (Brønsted–Lowry definíció szerint), pl. sav és lúg semlegesítése.
- Polimerizáció: kis molekulák egymáshoz kapcsolódva nagyobb lánc‑ vagy hálószerkezetet alkotnak (műanyagok előállítása).
- Foton‑indukált (fotokémiai) reakciók: fény hatására mennek végbe, például a fotoszintézisnél.
Reakciósebesség és tényezők
A reakciók lehetnek nagyon gyorsak vagy lassúak. A reakciósebességet befolyásoló fő tényezők:
- Hőmérséklet: magasabb hőmérsékleten a részecskék gyorsabban mozognak, nagyobb az ütközések energiája, így általában nő a reakciósebesség (például a fa hideg levegőn lassan korhad, de felhevítve égni kezd).
- Koncentráció: nagyobb reaktáns‑koncentráció több ütközést eredményez.
- Felület: szilárd részecskék esetén a nagyobb felület gyorsabb reakciót tesz lehetővé.
- Nyomás: gázok esetén a nagyobb nyomás hasonló hatású, mint a koncentráció növelése.
- Katalizátorok: olyan anyagok, amelyek csökkentik az aktiválási energiát és felgyorsítják a reakciót anélkül, hogy tartósan elhasználódnának (enzimek a biokémiai reakciók katalizátorai).
- Inhibitorok és pH: egyes anyagok lelassítják a reakciót, és sok biológiai reakció pH‑függő.
- Fény: fotokémiai reakcióknál elengedhetetlen tényező.
Energia és aktiválási energia
Reakciók során energia szabadulhat fel vagy nyelődhet el. Az exoterm reakciók hőt adnak le (pl. égés), míg az endoterm reakciók energiát vesznek fel (pl. bizonyos bomlási folyamatok). Minden reakciónak van egy ún. aktiválási energiája: az az energiagát, amelyet le kell küzdeni ahhoz, hogy a reakció elinduljon. A katalizátorok az aktiválási energiát csökkentve gyorsítják a reakciót.
Kémiai egyenletek és sztöchiometria
A kémiai egyenletek a reakciókat minősítik és mennyiségi kapcsolatokat is adnak a reaktánsok és termékek között — ez a sztöchiometria. Az egyenleteket mindig úgy kell rendezni (kiegyenlíteni), hogy a törzsadatoknak megfeleljen (minden típusú atom száma megegyezzen a reakció mindkét oldalán).
Visszafordíthatóság és egyensúly
Sok reakció visszafordítható: egyszerre zajlik előre és visszafelé, és idővel egyensúly áll be, amikor az előre és visszafelé menő reakciók sebessége kiegyenlítődik. Az egyensúly helyzete külső feltételek (hőmérséklet, nyomás, koncentráció) megváltoztatásával eltolható (Le Châtelier-elv).
Nukleáris reakciók vs. kémiai reakciók
A nukleáris reakciók nem kémiai reakciók. A kémiai reakciókban elsősorban az atomok külső héján lévő elektronok vesznek részt: kötéseket törünk fel és alakítunk ki. Nukleáris (mag)reakciók során viszont az atommagokban lévő protonok és neutronok változnak meg, és az ilyesfajta folyamatok sokkal más energiamérettartományban zajlanak (pl. hasadás, fúzió).
Mindennapi és ipari jelentőség
A kémiai reakciók mindenütt jelen vannak: az anyagok rozsdásodása, az ételek elkészítése, az élő szervezetek anyagcseréje, az akkumulátorok működése, és az ipari kémiai folyamatok mind reakciókon alapulnak. Ismeretük elengedhetetlen a biztonságos vegyianyag‑kezeléshez és a környezeti kockázatok mérsékléséhez.
Biztonság
A kémiai reakciók kezelésekor fontos a megfelelő óvintézkedések betartása: védőeszközök használata, jól szellőző tér, megfelelő tárolás és a reakciók energia‑kibocsátásának (pl. hő, gázok) figyelembevétele. Éghető, mérgező vagy robbanásveszélyes anyagokkal mindig körültekintően kell bánni.
Összefoglalva: a kémiai reakciók alapvető folyamatok, amelyek során anyagok szerkezete megváltozik, energia szabadulhat fel vagy nyelődhet el, és amelyeket a természettudományok és a technológia számos területén alkalmazunk.

Rozsdás vas

A máglya a redox példája
Négy alaptípus
Szintézis
A szintézisreakcióban két vagy több egyszerű anyag egyesül, hogy egy összetettebb anyagot alkosson.
A + B ⟶ A B {\displaystyle A+B\longrightarrow AB}
"Két vagy több reaktáns egy terméket ad" - ez egy másik módja a szintézisreakció azonosításának. A szintézisreakció egyik példája a vas és a kén kombinációja vas(II)-szulfid képződéséhez:
8 F e + S 8 ⟶ 8 F e S {\displaystyle 8Fe+S_{8}\longrightarrow 8FeS}
Egy másik példa az egyszerű hidrogéngáz egyszerű oxigéngázzal kombinálva egy összetettebb anyagot, például vizet eredményez.
Bomlás
Bomlási reakcióról akkor beszélünk, amikor egy összetettebb anyag egyszerűbb részeire bomlik. Ez tehát a szintézisreakció ellentéte, és a következőképpen írható le:
A B ⟶ A + B {\displaystyle AB\longrightarrow A+B}
A bomlási reakció egyik példája a víz elektrolízise, amelynek során oxigén- és hidrogéngáz keletkezik:
2 H 2 O ⟶ 2 H 2 + O 2 {\displaystyle 2H_{2}O\longrightarrow 2H_{2}+O_{2}}}
Egyszeri csere
Az egyszeri helyettesítő reakcióban egy vegyületben egyetlen nem egyesített elem egy másik elemet helyettesít; más szóval, egy elem helyet cserél egy másik elemmel egy vegyületben Ezek a reakciók általános formája a következő:
A + B C ⟶ A C + B {\displaystyle A+BC\longrightarrow AC+B}
Az egyszeri kiszorítási reakció egyik példája, amikor a magnézium a vízben lévő hidrogént magnézium-hidroxiddal és hidrogéngázzal helyettesíti:
M g + 2 H 2 O ⟶ M g ( O H ) 2 + H 2 {\displaystyle Mg+2H_{2}O\longrightarrow Mg(OH)_{2}+H_{2}}}
Dupla csere
A kettős helyettesítési reakcióban két vegyület anionjai és kationjai helyet cserélnek, és két teljesen különböző vegyületet alkotnak. Ezek a reakciók az általános formát követik:
A B + C D ⟶ A D + C B {\displaystyle AB+CD\longrightarrow AD+CB}
Például, amikor bárium-klorid (BaCl2 ) és magnézium-szulfát (MgSO4 ) reakcióba lép, az SO42− anion helyet cserél a 2Cl− anionnal, így a BaSO4és MgCl vegyületek keletkeznek2.
Egy másik példa a kettős kiszorítási reakcióra az ólom(II)nitrát és a kálium-jodid reakciója ólom(II)jodid és kálium-nitrát képződésével:
P b ( N O 3 ) 2 + 2 K I ⟶ P b I 2 + 2 K N O 3 {\displaystyle Pb(NO_{3})_{2}+2KI\longrightarrow PbI_{2}+2KNO_{3}}}
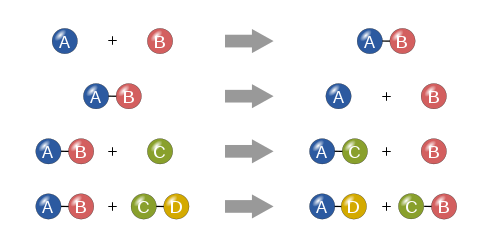
A négy alapvető kémiai reakciótípus: szintézis, bomlás, egyszeres helyettesítés és kettős helyettesítés.
Egyenletek
Egy kémiai reakciót egy egyenlet jelenít meg:
A + B ⟶ C + D {\displaystyle \mathrm {A+B\longrightarrow C+D} }
Itt A és B kémiai reakcióban reagál C-vel és D-vel.
Ez egy példa az égési reakcióra.
C + O 2 ⟶ C O 2 {\displaystyle \mathrm {C+O_{2}\longrightarrow CO_{2}} }
szén + oxigén → szén-dioxid
Kapcsolódó oldalak
- Szerves reakció
- Redox
Kérdések és válaszok
K: Mi az a kémiai reakció?
V: Kémiai reakció akkor történik, amikor egy vagy több vegyi anyag egy vagy több más vegyi anyaggá alakul át.
K: Tudna példákat mondani a kémiai reakciókra?
V: Igen, néhány példa a kémiai reakciókra: a vas és az oxigén egyesülése rozsdává, az ecet és a szódabikarbóna egyesülése nátrium-acetáttá, a szén-dioxid és a víz, a dolgok égése vagy robbanása, és számos reakció, amely az élőlényekben zajlik, például a fotoszintézis.
K: Minden kémiai reakció gyors?
V: Nem, egyes reakciók gyorsak, mások pedig lassúak. Egyesek különböző sebességgel játszódnak le, a hőmérséklettől vagy más dolgoktól függően.
K: Mi az az exoterm reakció?
V: Az exoterm reakció olyan reakció, amely energiát ad ki.
K: Mi az endoterm reakció?
V: Az endoterm reakció olyan reakció, amely energiát vesz fel.
K: A nukleáris reakciók kémiai reakcióknak minősülnek?
V: Nem, a nukleáris reakciók nem kémiai reakciók. A kémiai reakciókban csak az atomok elektronjai vesznek részt; a magreakciókban az atommagokban lévő protonok és neutronok vesznek részt.
K: A hőmérséklet befolyásolhatja a kémiai reakció sebességét?
V: Igen, a hőmérséklettől vagy más dolgoktól függően egyes reakciók különböző sebességgel játszódhatnak le. Például a fa nem reagál a levegővel, ha hideg, de ha eléggé felhevítjük, égni kezd.
Keres









