SN2 (bimolekuláris nukleofil szubsztitúció) — definíció és mechanizmus
SN2 (bimolekuláris nukleofil szubsztitúció): tömör definíció és lépésről lépésre mechanizmus, reakciósebesség, távozó csoportok és gyakorlati példák a szerves kémiában.
Az SN 2 reakció (más néven bimolekuláris nukleofil szubsztitúció) egy szubsztitúciós reakció a szerves kémiában. Ez a nukleofil szubsztitúció egyik típusa, amikor egy nukleofil (többnyire elektronpár-vezető) megtámad egy elektronhiányos elektrofil centrumot, és kötődik hozzá, miközben a helyét egy rosszabb kötőképes, úgynevezett távozó csoport foglalja el. A folyamat során a belépő csoport egyetlen, összehangolt lépésben helyettesíti a kilépő csoportot, ezért a mechanizmust gyakran egylépésesnek nevezik. Mivel a reakció sebességét a sebességmeghatározó lépésében két résztvevő — a nukleofil és a szubsztrát — koncentrációja határozza meg, az elnevezésben szerepel a bimolekuláris szó. A szervetlen kémikusok körében az SN 2 reakciót gyakran cseremechanizmusként is ismerik.
Mechanizmus és átmeneti állapot
Az SN 2 mechanizmus lényege a hátsó (backside) támadás: a nukleofil ellentétes irányból közelíti meg a C–X (X = távozó csoport) kötet, és egyidejűleg részleges kötések alakulnak ki a nukleofil és a szén között, míg a kilépő csoport kötéserőssége csökken. Az átmeneti állapot jellemzője a részben ötkoordinált, pentakoordinált szerkezet (részleges kötésekkel a be- és kilépő csoportokhoz). Ennek következménye a Walden-inverzió: ha a kiindulási centrum sztereocentrum volt, a termék konfigúrációja 180°-kal fordul meg (inverzió).
Kinetika
Az SN 2 reakciók sebességtörvénye tipikusan másodrendű:
- rate = k [szubsztrát] [nukleofil]
Ez azt jelenti, hogy mindkét reaktáns koncentrációja befolyásolja a reakció sebességét, mert a sebességmeghatározó lépésben mindkét komponens részt vesz.
Főbb tényezők, amelyek befolyásolják az SN 2 reakciót
- Szubsztrát szerkezete: A sterikus gátlás döntő. Methyl > 1° > 2° esetén gyors, 3° gyakorlatilag kizárt az SN 2 miatt a nagy sterikus torlódás.
- Nukleofil erőssége: Erős, negatív töltésű és kevéssé delokalizált nukleofilek (például CN−, RS−, I−) gyorsítják az SN 2-t. A nukleofil reaktivitását csökkentik a szolvatációs kölcsönhatások és az elektronvonzó csoportok a közelben.
- Távozó csoport képessége: Jó távozó csoport (stabil töltés a kilépés után) — pl. I−, Br−, tosylát — elősegíti a reakciót. A fluorid rossz távozó csoport miatt általában lassú.
- Oldószer: Polar aprotikus oldószerek (pl. DMSO, DMF, aceton) kedvezőek, mert nem hidrogénezik erősen a nukleofilt, így az erősebbé válik. Polar protikus oldószerek (pl. víz, alkoholok) hidrogénezéssel gyengítik a nukleofilt, ezáltal lassítják az SN 2 reakciót.
- Hőmérséklet és koncentrációk: magasabb hőmérséklet és nagyobb nukleofil koncentráció gyorsíthatja a reakciót; a kinetika másodrendű voltából következik a koncentrációk jelentős szerepe.
Stereokémia
Sztereocentrumon végbemenő SN 2 reakció esetén a támadás hátsó irányú jellege miatt a termék konfigurációja megfordul (teljes vagy majdnem teljes Walden-inverzió). Ez fontos szempont szintetikus sztereokontrollban, például aszimmetrikus szintéziseknél vagy gyógyszerkémiai előállításnál.
Versengő folyamatok
Bizonyos körülmények között az SN 2 versenyez más reakciókkal:
- SN1: ha a szubsztrát stabil karbokationt tud képezni (pl. 3°), és az oldószer polar protikus, akkor az SN1 mechanizmus válhat dominánssá.
- E2 elimináció: erős, sterikusan nagy bázisok esetén (pl. t-BuO−) az E2 elimináció gyakran versenyez vagy felülírja az SN 2-t, különösen 2° és 3° szénközpontoknál.
Gyakorlati példák és alkalmazás
- CH3Br + CN− → CH3CN + Br− — egyszerű, gyors SN 2 példa, mivel a metilcsoportnál nincs sterikus gátlás.
- 2-bromobutan + OH− → 2-butanol (inverzióval) — másodlagos szénnél reagálhat SN 2 útvonalon, de a körülményektől függően versenyezhet az E2-vel.
- Szerves szintéziseknél az SN 2-t gyakran alkalmazzák alkilációk, funkciócsere lépések és védőcsoportok eltávolítása során, különösen, ha sztereokémiát kívánnak megőrizni vagy invertálni.
Összefoglalás
Az SN 2 egy egylépéses, bimolekuláris nukleofil szubsztitúció, amelyben a nukleofil hátulról támadva egyidejűleg kötődik a szénhez és kiszorítja a távozó csoportot. A reakció sebessége a szubsztrát és a nukleofil koncentrációjától függ, erősen befolyásolja a szubsztrát sterikája, a nukleofil ereje, a távozó csoport jósága és az oldószer típusa. Az SN 2 mechanizmus fontos eszköz a szerves szintézisben, különösen olyan esetekben, amikor sztereokémiai inverziót kívánnak elérni.
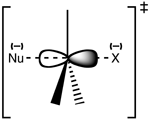
Az SN 2 átmeneti állapot felépítése
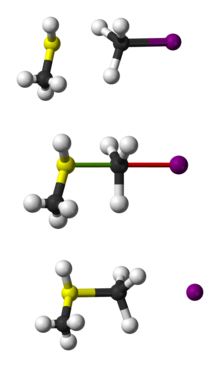
A CH3 SH és a CH3 I közötti SN 2 reakció gömb-pálcás ábrázolása.
Reakciómechanizmus
A reakció leggyakrabban egy olyan alifás sp3 széncentrumon megy végbe, amelyhez egy elektronegatív, stabil távozó csoport - "X" - kapcsolódik, gyakran egy halogenidatom. A C-X kötés felszakadása és az új C-Nu kötés kialakulása egyidejűleg történik, és egy olyan átmeneti állapot jön létre, amelyben a nukleofil támadásnak kitett szén pentakoordinált és megközelítőleg sp2 hibridizált. A nukleofil a kilépő csoporthoz képest 180°-ban támadja a szenet, mivel ez biztosítja a legjobb átfedést a nukleofil magányos párja és a C-X σ* antibonding orbitál között. A kilépő csoport ezután eltolódik az ellentétes oldalról, és a termék keletkezik.
Ha a nukleofil támadás alatt álló szubsztrát királis, ez - bár nem feltétlenül - a sztereokémia inverziójához, az úgynevezett Walden-inverzióhoz vezethet.
Az SN 2 reakció egyik példájában az OH −(nukleofil) és a brómetán (elektrofil) támadása etanolt eredményez, a bromid pedig távozó csoportként távozik:
SN 2 reakció akkor következik be, ha a hátsó támadási útvonalat a molekula más atomjai nem akadályozzák (a szubsztituensek a szubsztráton sterikusan akadályozzák). Tehát ez a mechanizmus általában egy akadálymentes primer széncentrumon történik. Ha a szubsztráton a kilépő csoport közelében, például egy tercier széncentrumnál, sztérikus zsúfoltság van, akkor a szubsztitúció SN 1 helyett SN 2 mechanizmust fog alkalmazni (blokkolt molekulák esetén az SN 1 is valószínűbb lenne, mert egy kellően stabil karbokation-középső képződhetne).
A koordinációs kémiában az asszociatív szubsztitúció az SN 2 -hoz hasonló mechanizmussal történik.
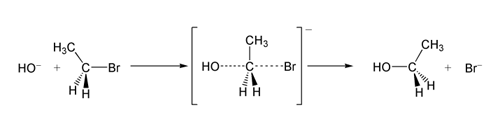
SN 2 brómetán reakciója hidroxidionnal.
A reakció sebességét befolyásoló tényezők
A reakció sebességét négy tényező befolyásolja:
- Alátét. A szubsztrát játssza a legfontosabb szerepet a reakció sebességének meghatározásában. Ennek oka, hogy a nukleofil a szubsztrát hátsó oldaláról támad, így bontja meg a szén-leváló csoport kötését és alakítja ki a szén-nukleofil kötést. Ezért az SN 2 reakció sebességének maximalizálása érdekében a szubsztrát hátoldalának a lehető legakadálymentesebbnek kell lennie. Összességében ez azt jelenti, hogy a metil és az elsődleges szubsztrátok reagálnak a leggyorsabban, majd a másodlagos szubsztrátok következnek. A tercier szubsztrátok nem vesznek részt az SN 2 reakcióban a sztérikus akadályok miatt.
- Nukleofil. A szubsztráthoz hasonlóan a sztérikus akadályok is befolyásolják a nukleofil erősségét. A metoxid-anion például egyszerre erős bázis és nukleofil, mivel metil-nukleofil, és így nagyon akadálytalan. A terc-butoxid viszont erős bázis, de gyenge nukleofil, mert három metilcsoportja akadályozza a szénhez való közeledését. A nukleofil erősségét a töltés és az elektronegativitás is befolyásolja: a nukleofilitás a negatív töltés növekedésével és az elektronegativitás csökkenésével nő. Például az OH- jobb nukleofil, mint a víz, és az I- jobb nukleofil, mint a Br- (poláros protikus oldószerekben). A poláros aprotikus oldószerben a nukleofilitás a periódusos rendszer egy oszlopával felfelé növekszik, mivel az oldószer és a nukleofil között nincs hidrogénkötés. Ebben az esetben a nukleofilitás a bázicitás tükörképe. Az I- tehát gyengébb nukleofil lenne, mint a Br- , mivel gyengébb bázis.
- Oldószer. Az oldószer befolyásolja a reakció sebességét, mivel az oldószerek körülvehetik vagy nem veszik körül a nukleofilt, és így akadályozzák vagy nem akadályozzák a szénatomhoz való közeledését. A poláros aprotikus oldószerek, mint például a tetrahidrofurán, jobb oldószerek ehhez a reakcióhoz, mint a poláros protikus oldószerek, mert a poláros protikus oldószereket az oldószer hidrogénkötése a nukleofilhoz oldja. Ez megakadályozza, hogy a távozó csoporttal megtámadja a szenet.
- Elhagyja a csoportot. A távozó csoport befolyásolja a reakció sebességét. Minél stabilabb a kilépő csoport, annál valószínűbb, hogy a nukleofil támadásakor a szénnel szemben a nukleofil a szén két elektronját is magával viszi a kilépő csoport kötésébe. Ezért minél gyengébb a kilépő csoport mint konjugált bázis, annál jobb a kilépő csoport. Hasonlóképpen, minél erősebb a megfelelő sav, annál jobb a távozó csoport. A jó távozócsoportokra példák a halogenidek (kivéve a fluoridot) és a toszilát. A HO- és a H2 N- azonban nem jó távozócsoportok.
Reakciókinetika
Az SN 2 reakció sebessége másodrendű, mivel a sebességet meghatározó lépés függ a nukleofil koncentrációjától, [Nu− ], valamint a szubsztrát koncentrációjától, [RX].
r = k[RX][Nu− ]
Ez az egyik legfontosabb különbség az SN 1 és az SN 2 mechanizmusok között. Az SN 1 reakcióban a nukleofil a sebességkorlátozó lépés után támad. Az SN 2 reakcióban azonban a nukleofil a sebességkorlátozó lépésben kiszorítja a távozó csoportot. Más szóval, az SN 1 reakciók sebessége csak a szubsztrát koncentrációjától függ, míg az SN 2 reakció sebessége a szubsztrát és a nukleofil koncentrációjától is. Azokban az esetekben, ahol mindkét mechanizmus lehetséges (például egy másodlagos széncentrumnál), a mechanizmus függ az oldószertől, a hőmérséklettől, a nukleofil koncentrációjától vagy a távozó csoporttól.
Az SN 2 reakciókat általában elsődleges alkil-halogenidek vagy másodlagos alkil-halogenidek aprotikus oldószerrel történő reakciói kedveznek. Tercier alkilhalogenidekben a sztérikus akadályok miatt elhanyagolható mértékben játszódnak le.
SN 2 és SN 1 a reakciók csúszó skálájának két szélső értéke. Számos olyan reakciót lehet találni, amelyek mechanizmusában mind az SN 2, mind az SN 1 karaktert mutatják. Lehetséges például, hogy egy alkil-halogenidből olyan kontaktionpárok keletkeznek, amelyekben az ionok nem válnak el teljesen. Amikor ezek szubsztitúciónak mennek át, a sztereokémia sok reagáló molekula esetében inverz lesz (mint az SN 2 esetében), de néhány esetben a konfiguráció megtartása is előfordulhat. Az SN 2 reakciók gyakoribbak, mint az SN 1 reakciók.
E2 verseny
Az SN 2 reakcióknál gyakran lejátszódó mellékreakció az E2 elimináció: a bejövő anion nukleofil helyett bázisként viselkedhet, eltávolítva egy protont, ami az alkén kialakulásához vezet. Ez a hatás egy szulfonát és egy egyszerű alkil-bromid közötti gázfázisú reakcióban mutatható be, amely egy tömegspektrométerben zajlik:

Etil-bromiddal a reakciótermék túlnyomórészt szubsztitúciós termék. Az elektrofil centrum körüli sztérikus akadályok növekedésével, mint az izobutil-bromid esetében, a szubsztitúciót nem kedvelik, és az elimináció a domináns reakció. Az eliminációt elősegítő egyéb tényezők a bázis erőssége. A kevésbé bázikus benzoát szubsztráttal az izopropil-bromid 55%-os szubsztitúcióval reagál. Általánosságban elmondható, hogy az ilyen típusú gázfázisú reakciók és az oldatfázisú reakciók ugyanazokat a tendenciákat követik, bár az előbbinél az oldószerhatások elmaradnak.
Körforgalom mechanizmus
A 2008-ban figyelmet keltő fejlesztés egy SN 2 körkörös mechanizmussal kapcsolatos, amelyet a kloridionok és a metil-jodid közötti gázfázisú reakcióban figyeltek meg egy speciális technikával, az úgynevezett keresztezett molekulasugaras képalkotással. Ha a kloridionok kellő sebességgel rendelkeznek, a keletkező jodidionok energiája az ütközés után sokkal kisebb a vártnál, és az elmélet szerint a metilcsoportnak a jódatom körüli teljes megkerülésével veszik el az energiát, mielőtt a tényleges elmozdulás megtörténne.
Kapcsolódó oldalak
- Helyettesítési reakció
- SN 1 reakció
Keres