Átmeneti állapot
Egy kémiai reakcióban az átmeneti állapot az a pont, ahol az energia maximális értéke van. Ezt az energiát aktiválási energiának nevezzük. Amikor két vagy több molekula keveredik, egymásnak ütközik. Ha elég energiával ütköznek ahhoz, hogy átmenjenek az átmeneti állapoton, akkor reakcióba lépnek, és új molekulák keletkeznek. Az átmeneti állapotban új kötések jönnek létre, miközben a régiek megszakadnak. Egy grafikonon vagy rajzon az átmeneti állapotot gyakran a kettős tőr ‡ szimbólummal jelölik.
Nagyon nehéz egy átmeneti állapotot tanulmányozni. Ennek oka, hogy olyan nagy energiájú, hogy a molekulák csak nagyon rövid ideig, általában femtoszekundumig maradnak ebben az állapotban. Fontos, hogy ne keverjük össze az átmeneti állapotokat a köztes állapotokkal. A köztes állapotok az energia minimumpontjainál találhatók, és nagyon hosszú ideig élhetnek. Az átmeneti állapotokhoz hasonlóan azonban egy köztes állapot is egy reakció reagensek és termékek között helyezkedik el.
Az átmeneti állapotok tanulmányozása nagyon fontos a reakciómechanizmusok megértéséhez. Vannak elméletek és számítógépes programok, amelyek segítségével kiszámítható, hogyan néz ki az átmeneti állapot. Ez a kémiai kinetika része.
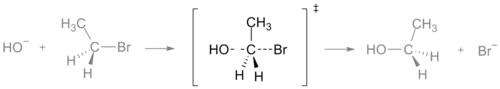
Az SN2-reakció átmeneti állapota
Kérdések és válaszok
K: Mi az átmeneti állapot egy kémiai reakcióban?
V: Az átmeneti állapot az a pont, ahol egy kémiai reakcióban az energia maximális értéke van.
K: Mi az aktiválási energia egy kémiai reakcióban?
V: A reakció bekövetkezéséhez szükséges energiát nevezzük aktiválási energiának.
K: Mi történik, ha két vagy több molekula keveredik egy kémiai reakcióban?
V: Amikor két vagy több molekula keveredik, egymásnak ütköznek. Ha elég energiával ütköznek ahhoz, hogy átmenjenek az átmeneti állapotba, akkor reakcióba lépnek, és új molekulák keletkeznek.
K: Mire használják a kettős tőr (‡) szimbólumot egy kémiai reakció grafikonján vagy rajzán?
V: A kettős tőr (‡) szimbólumot az átmeneti állapot jelölésére használják egy kémiai reakció grafikonján vagy rajzán.
K: Miért nehéz egy kémiai reakcióban az átmeneti állapotot tanulmányozni?
V: Azért nagyon nehéz tanulmányozni az átmeneti állapotot egy kémiai reakcióban, mert olyan nagy energiájú, hogy a molekulák csak nagyon rövid ideig, általában femtoszekundumokig maradnak ebben az állapotban.
K: Mi a köztes állapot egy kémiai reakcióban?
V: A köztes állapot olyan molekula, amely egy kémiai reakcióban a minimális energiapontokon található, és nagyon hosszú ideig képes élni.
K: Miért fontos az átmeneti állapotok tanulmányozása a reakciómechanizmusok megértésében?
V: Az átmeneti állapotok tanulmányozása azért fontos a reakciómechanizmusok megértésében, mert segít meghatározni, hogyan megy végbe egy reakció, és hogyan lehet azt irányítani vagy manipulálni.
Keres