Magányos elektronpár: definíció, tulajdonságok és szerepe a molekulákban
Magányos elektronpár: részletes definíció, tulajdonságok és szerep a molekulákban — nukleofil viselkedés, hatás a molekulaalakra és kötésképző képesség.
A magányos elektronpár olyan két elektronból álló csoport, amely nem vesz részt az atomok közötti kötésekben. Mindig az atom utolsó héjában, a valenciahéjban vannak. A kötésekben használt elektronokkal együtt alkotják a valenciaelektronok teljes számát. Általában nagy energiájúak.
A magányos pár felhasználható új kötések kialakítására a molekulák között. A nukleofilok mindig rendelkeznek egy magányos párral, amelyet az elektrofil megtámadására használnak. A magányos párok a molekula alakja szempontjából is fontosak. Több helyet foglalnak el egy atom körül, mint egy kötőelektron. Az azonos atomon lévő magányos párok a lehető legtávolabb akarnak lenni egymástól.
Definíció és kvantumkémiai szemlélet
A magányos elektronpár (nonbonding pair) két, ugyanazon atomhoz tartozó elektronpár, amelyek nem vesznek részt kovalens kötés létrehozásában. Lewis-ábrázolásban pontokkal jelöljük őket; kvantumkémiai leírásban a nemkötő (nonbonding) molekulapályákon helyezkednek el. Az ilyen párok energiája általában a kötő- és az antikötő pályák közötti tartományba esik, de tényleges energiájukat befolyásolja az atom elektronegativitása és a környező elektronrendszer (pl. delokalizáció).
Tulajdonságok és hatások
- Térigény: A magányos párok nagyobb térállásigénnyel rendelkeznek, mint a kötőelektronpárok, ezért hatnak a kötési szögekre (VSEPR-elv).
- Reaktivitás: A magányos párok a nukleofil reakciók forrásai: donorként szolgálnak, koordinációs kötést vagy új kovalens kötést hoznak létre.
- Alaposság és nukleofilitás: A magányos párral rendelkező atom alapossága (Brønsted–Lowry) és nukleofilitása (Lewis) függ az elektronegativitástól, polarizálhatóságtól, oldószertől és sterikai környezettől.
- Hidrogénkötés: Olyan atomok (pl. O, N, F) magányos párai hidrogénkötésekben vehetnek részt mint akceptorok, ami befolyásolja a molekula forráspontját, oldhatóságát és szerkezetét.
- Delokalizáció és rezonancia: Ha a magányos pár kapcsolódó π-rendszerbe illeszthető (pl. fenolát, amid), akkor delokalizálódhat, ami csökkenti reakciókészségét és módosítja az elektroneloszlást.
- Spektrális és elektron-density jelek: A magányos párok hatással vannak dipólusmomentumra, IR- és UV/VIS-abszorpciókra, valamint elektron-sűrűség térképeken (röntgen/neutron diffrakció, elektronspin-spektroszkópia) is megmutatkoznak.
Hatás a molekula geometriájára (VSEPR)
A VSEPR-elv (elektronpár taszítás elve) szerint a kötések és a magányos párok úgy helyezkednek el, hogy minimalizálják az elektromos taszítást. Ennek következményei:
- Magányos párok nagyobb taszítást fejtenek ki, mint kötőelektronok, ezért csökkentik a kötési szögeket. Például a CH4 (tetraéderes, 109,5°) helyett NH3-ben a kötésszög kb. 107°, míg H2O-ban kb. 104,5°.
- A molekulaszerkezetet kétféleképpen különböztetjük meg: az elektronpár-geometria (minden elektronpárra vonatkozó geometria) és a molekulageometria (csak az atomok helyzetét figyelembe véve).
- Több magányos pár megléte tovább torzítja a geometriát (pl. két magányos pár az alap esetben nagyobb szögcsökkentést okoz, mint egyetlen magányos pár).
Kémiai szerep és példák
- Nukleofil támadás: A magányos párok közvetlenül részt vesznek nukleofil folyamatokban — a nukleofil elektronpárja kötődik az elektrofilhez (pl. OH−, NH3 reakciói).
- Kötésdonor: Koordinációs kémiai rendszerekben (fémkomplexek) a ligandumok magányos párjaiból indulhatnak a koordinatív kötések (Lewis-bázis → Lewis-sav).
- Rezonancia példák: Az anilinnél az aminos csoport magányos párja delokalizálódik a gyűrűbe, ami csökkenti bázikusságát; az amidoknál az N-lone pair erősen delokalizált a karbonil köré, ezért az amid kevésbé bázisos, mint egy egyszerű amin.
- Hidrogénkötés: A vízmolekula két magányos párt tartalmazó oxigénje kiváló hidrogénkötés-akceptor; ez magyarázza a víz különleges fizikai tulajdonságait.
- Stereokémiai hatások: Nehéz p-blokk elemeknél (pl. Sn(II), Pb(II)) előfordulhat az ún. "inert pair effect": az s-pár látszólag nem vesz részt kötésekben és lehet stereokémiailag aktív (szögeltérések, aszimmetria).
Ábrázolás, formális töltés és számítási jelek
- Lewis-ábrázolás: magányos párok pontokkal jelennek meg az atomok mellett.
- Formális töltés: a magányos párok szerepét figyelembe véve a formális töltés számítása fontos a legvalószínűbb szerkezet kiválasztásához (pl. nitrátion, karboxilátok esetén).
- Számítógépes kémia: a nemkötő molekulapályák lokalizációja és energiaértéke meghatározható módszerekkel (MO-analízis, DFT), amelyek megmutatják a magányos párok szerepét a reaktivitásban és spektrumban.
Gyakorlati példák (összefoglaló)
- H2O: az oxigénnek két magányos párja van → V-alak, 104,5°
- NH3: nitrogén egy magányos párja → piramis alak, ~107°
- Cl− és halogenidek: több magányos pár, amelyek befolyásolják polaritást és intermolekuláris kölcsönhatásokat
- Amidok: az N-lone pair delokalizált → kisebb bázikusság
- Koordinációs komplexek: ligandumok lone pairjei a fém központdonorai
Összefoglalás
A magányos elektronpárok kulcsfontosságú szereplők a molekuláris szerkezetben és kémiai reakciókban: befolyásolják a molekula geometriáját, reaktivitását, bázikusságát és intermolekuláris kölcsönhatásait. Energiájuk és viselkedésük a környezettől (elektronegativitás, delokalizáció, oldószer, sterika) függ, ezért reakciók és szerkezetek megértéséhez elengedhetetlen ezek figyelembevétele.
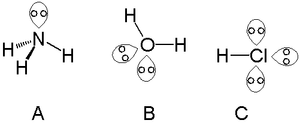
Magányos párok ammóniában (A), vízben (B) és sósavban (C)
Keres