Kovalens kötés: definíció, működés és példa (víz, polaritás)
Ismerd meg a kovalens kötés definícióját, működését és a víz polaritásán keresztüli példáját — világos magyarázat, gyakorlati példák és szemléltetés.
A kovalens kötések általában két nem fématom között kialakuló kémiai kötések, amelyek során az atomok a valenciaelektronjaikat megosztva érik el az alacsonyabb energiájú állapotokat és a stabilabb elektroneloszlást. Klasszikus példája ennek a víz, amely H2O formában egy oxigén és két hidrogén atomból áll. A vegyértékhéj (külső héj) telítettségére vonatkozó egyszerű szabály szerint a stabil konfiguráció általában nyolc elektront tartalmaz (a hidrogén és a hélium kivételével, amelyek esetében ez kettő), ezt az elvet gyakran oktett-szabályként említjük. A valenciaelektronok az atom külső héjában található, viszonylag lazábban kötött elektronok, és az elektronhéjak szerkezetét a kvantummechanika határozza meg.
Hogyan jön létre a kovalens kötés?
A kovalens kötés akkor alakul ki, amikor két atom közel kerül egymáshoz és elektronpályáik átlapolódnak, így a valenciaelektronok közösen töltik be a két atom körüli molekulapályákat. Kvantummechanikai szempontból az atomok atomorbitáljai kombinálódnak, és kialakulnak a kötő (alacsonyabb energiájú) és a kötésellenes (magasabb energiájú) molekulapályák; az elektronok a kötőpályákon foglalnak helyet, és ez az állapot energiát szabadít fel. A felszabaduló energia általában hőként disszipálódik, de bizonyos esetekben részecskéket (például fotonokat) is kibocsáthat.
A megosztás mértéke változó:
- Ha az elektronok megosztása között nincs vagy kicsi az eltérés, a kötés nem poláris kovalens (pl. H–H, Cl2).
- Ha az egyik atom erősebben vonzza az elektronokat (nagyobb elektronegatívitás), akkor a megosztás egyenlőtlen, és a kötés poláris kovalens lesz: az egyik atom részleges negatív (δ–), a másik részleges pozitív (δ+) töltést kap.
Kötéstípusok és jellemzőik
- Egyszeres, kettős és hármas kötések: az atomok közötti megosztott elektronpárok számától függően. Több kötő elektronpár (nagyobb kötésrend) rövidebb és erősebb kötéssel jár.
- Szigma (σ) és pi (π) kötések: az orbitálok átlapolódásának geometriája szerint; az egyszeres kötés jellemzően σ-kötés, kettős és hármas kötéseknél π-kötések is jelen vannak.
- Koordinatív (dativ) kötés: amikor az egyik atom mindkét kötőelektront adja a közös párhoz (példa: NH4+ képződése, amikor a nitrogén egy párral adományoz az előzőleg pozitív töltésű központnak).
- Kötésenergia és kötéstávolság: a kötés kialakulásakor energia szabadul fel (kötésenergia), a kötés felbontásához ugyanolyan nagyságú energiára van szükség. A rövidebb kötések általában erősebbek.
Elektronszerkezet, héjak és töltés
Egy semleges atom elektronainak száma megegyezik a protonok számával, de kémiai reakciók során ionok is keletkezhetnek, amelyek töltése eltér. A réteges elektronmodell egyszerűen azt mondja, hogy az első héj legfeljebb két elektront tartalmazhat, a külsőbb héjak — egyszerűsített oktett-szemléletben — általában legfeljebb nyolcat igyekeznek betölteni, de a valóságban az egyes főkvantumszintek kapacitását a 2n^2 szabály írja le. A kovalens kötés során az elektronok megosztása csökkenti az összrendszer energiáját és stabilitást eredményez.
Példa: a víz és a polaritás
A vízmolekula egy tipikus és jól ismert példa a poláris kovalens kötésre. Az oxigénatom két külső elektronját osztja meg két hidrogénatom egyik-egy elektronjával, így két egyszeres (σ) kovalens kötés jön létre. Fontos megjegyezni, hogy az oxigén erősebb elektronegatív (erősebben vonzza az elektronokat), ezért az elektronsűrűség a kötésben eltolódik az oxigén felé. Ennek következtében az oxigén részleges negatív töltést (δ–), a hidrogének részleges pozitív töltést (δ+) kapnak — ellentétben az eredeti szöveg egy hibás állításával.
Emellett a vízmolekula geometriai alakja fontos: az oxigén körüli kötési szög kb. 104,5°, tehát a molekula nem lineáris, hanem hajlított. Ez a szerkezet együtt az elektroneloszlás egyenlőtlenségével eredményezi a molekula dipólusmomentumát, így a víz poláris molekula. A polaritás gyakorlatias következménye például a víz jó oldószerként viselkedése ionos és poláris anyagok számára, illetve a molekulák közötti hidrogénkötések kialakulása, amelyek sok fizikai tulajdonságáért (magas forráspont, felületi feszültség stb.) felelősek.
Korlátozások és kivételek
- Az oktett-szabály nem mindig érvényes: például a hidrogén (2 elektron elég), a berillium és a bór gyakran kevesebb mint nyolc elektronnal stabil; nagyobb periódusú elemek (például kén, foszfor) pedig kiterjeszthetik az oktettet.
- A kovalens és ionos kötés között folyamatos átmenet van; sok vegyületnek részleges ionos és részleges kovalens jellege van.
Összefoglalva: a kovalens kötés az atomok közötti elektronmegosztáson alapuló kötés, amely a molekulák szerkezetét és tulajdonságait nagymértékben meghatározza. A kötés polaritását elsősorban az elektronegatívitás különbsége és a molekula geometriai felépítése határozza meg, amint azt a víz kiválóan szemlélteti.
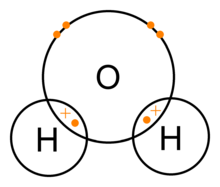
A víz kovalens kötései (H2O)
A kovalens kötés típusai
Az atomi pályák (kivéve az s pályákat) különböző típusú kovalens kötéseket hoznak létre:
- A szimmás (σ) kötések a legerősebb kovalens kötések. Két különböző atom orbitálisainak fej-fej melletti átfedésével járnak. Egyetlen kötés általában egy σ-kötés.
- A pi (π) kötések gyengébbek, és a p (vagy d) orbitálok közötti oldalirányú átfedésnek köszönhetőek.
- A két adott atom közötti kettős kötés egy σ és egy π kötéssel rendelkezik, és
- a hármas kötés egy σ és két π kötéssel rendelkezik.
A kovalens kötések gyengébbek, mint az ionos kötések, és alacsonyabb az olvadáspontjuk. Általában rosszul vezetik az elektromosságot és a hőt.
Kötéshossz
A kémiában a kötéshossz a kovalens kötés méretének mérőszáma. Mivel a molekulák nagyon kicsik, pikométerben, azaz a méter milliárdod részének milliomod részében mérik őket.
A molekulák kémiáját leginkább a kötéseik magyarázzák, a kötéseket pedig az elektronok szerkezete okozza.
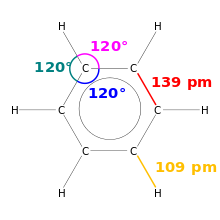
Benzol rajzolása. A kötéshosszok és a kötésszögek fel vannak tüntetve.
Kapcsolódó oldalak
- Valencia
Kérdések és válaszok
K: Mi az a kovalens kötés?
V: A kovalens kötés két nem fémes atom közötti kémiai kötés, ahol az atomok megosztják egymással a valenciaelektronokat. Ezáltal egy olyan elektronpálya jön létre, amely mindkét atommaghoz kötődik, és alacsonyabb energiaszinttel rendelkezik, mint az eredeti elektronpálya. Ennek eredményeként az elektront átadó atom kis nettó pozitív töltéssel, a másik atom pedig kis nettó negatív töltéssel rendelkezik, amelyeket a pozitív és negatív töltések közötti elektromágneses vonzóerő tart össze.
K: Hány elektron van általában egy atom külső héjában?
V: Egy atom külső héjában általában legfeljebb nyolc elektron van, hidrogén vagy hélium esetében kettő.
K: Mi határozza meg az atomban lévő elektronok számát?
V: Az atomban lévő elektronok számát az atomban lévő protonok száma határozza meg.
K: Hogyan alakulnak ki a kovalens kötések?
V: A kovalens kötések akkor jönnek létre, amikor az atomok közel kerülnek egymáshoz, és az egyik atomból egy lazán tartott elektron egy új pályára ugrik, amely mindkét atommaghoz alacsonyabb energiaszinttel kötődik, mint korábban. Ennek eredményeképpen az egyik atom kis nettó pozitív töltéssel, a másik pedig kis nettó negatív töltéssel rendelkezik, ami elektromágneses vonzóerőt hoz létre közöttük.
K: Milyen típusú molekula a víz?
V: A vízmolekulák egy oxigénatomból és két hidrogénatomból állnak, amelyeket kovalens kötések tartanak össze, így poláris molekulának számít, mivel töltése nem egyenletesen oszlik el.
K: Hol keringenek az elektronok az atommagok körül?
V: Az elektronok úgy keringenek az atommagok körül, mint a homályos pályák.
Keres