Sav
Az adatbázisok bizonyos tulajdonságairól szóló cikk az ACID oldalon található.
Néha az acid az LSD (lizergsav-dietilamid) másik neve.
A sav olyan anyag, amely egy hidrogéniont (H+ ) (általában egy protont) képes leadni egy másik anyagnak. A savak pH-ja 7,0-nál kisebb. Egy vegyi anyag akkor tud protont adni, ha a hidrogénatom egy elektronegatív atomhoz, például oxigénhez, nitrogénhez vagy klórhoz kapcsolódik. Egyes savak erősek, mások gyengék. A gyenge savak megtartják néhány protonjukat, míg az erős savak az összeset leadják. Minden sav hidrogénionokat bocsát ki az oldatokba. A molekulánként felszabaduló ionok mennyisége határozza meg, hogy a sav gyenge vagy erős. A gyenge savak azok a savak, amelyek részben elengedik a hozzájuk kötődő hidrogénatomokat. Ezek a savak tehát a hidrogénionok disszociációjával csökkenthetik a pH-t, de nem teljesen. A gyenge savak pH-értéke általában 4-6, míg az erős savaké 1-3 közötti.
A bázis a sav "kémiai ellentéte". A bázis olyan anyag, amely a sav hidrogénatomját befogadja. A bázisok olyan molekulák, amelyek vízben szét tudnak hasadni, és hidroxidionokat szabadítanak fel.

Sósav (a főzőpohárban) ammóniagőzzel reakcióba lépve ammónium-kloridot (fehér füst) termel.
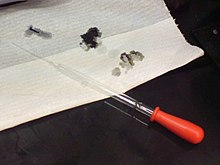
A savak veszélyesek lehetnek: A lyukakat a papíron egy 98%-os kénsavas oldat okozta.
Hogyan működnek a savak
A savak és bázisok általában együtt léteznek egyensúlyban. Ez azt jelenti, hogy egy savmintán belül egyes molekulák leadják a protonjaikat, mások pedig felveszik azokat. Még a víz is egy savas ion, H3 O +(hidróniumion) és egy bázikus ion, OH- (hidroxidion) keveréke. A hidróniumion leadja a protonját egy hidroxidionnak, két molekula H2 O-t alkotva, amely semleges. Ez a reakció folyamatosan lejátszódik egy vízmintában, de összességében a minta semleges, mivel a mintában egyenlő mennyiségű hidrónia és hidroxid van. A legtöbb reakcióban azonban a savak és bázisok nem egyenlő mennyiségben vannak jelen, és ez az egyensúlyhiány teszi lehetővé a kémiai reakciót.
Minden savnak van egy konjugált bázisa, amely a sav protonjának eltávolításával jön létre. A sósav (HCl) például egy sav, és a konjugált bázisa egy klór-anion, vagy Cl-. A sav és konjugált bázisa ellentétes erősségű. Mivel a HCl erős sav, a Cl -gyenge bázis.
Tulajdonságok
A savak különböző erősségűek lehetnek, egyesek reaktívabbak, mint mások. A reaktívabb savak gyakran veszélyesebbek.
A savak molekulaszerkezetüktől függően sokféle tulajdonsággal rendelkezhetnek. A legtöbb sav a következő tulajdonságokkal rendelkezik:
- savanyú ízűek, amikor megeszik őket
- csípheti a bőrt, ha megérintik őket.
- korrodálhatja (vagy felemésztheti) a fémeket és a bőrt.
- az elektrolízis során a mozgó ionok jelenléte miatt reakcióközegként használható
- a kék lakmuszpapírt pirosra változtatja
- pirosra vagy narancssárgára vált az univerzális jelzőn
- vezetni az elektromosságot
A savak égethetik a bőrt, az égés súlyossága a sav típusától és koncentrációjától függ. Ezek a kémiai égési sérülések azonnali orvosi ellátást igényelnek.
Mivel a savak hidrogénionokat adnak le, minden savnak hidrogént kell tartalmaznia.

Figyelmeztető kép veszélyes savakkal és veszélyes bázisokkal együtt használva. A bázisok a savak ellentétei.
Fontosság
A savak fontosak. A nukleinsavak, például a DNS és az RNS tartalmazzák a genetikai kódot. Ezek a molekulák határozzák meg egy szervezet számos tulajdonságát, a szülőkről az utódokra szállnak. A DNS tartalmazza a terveket, hogyan épüljenek fel a fehérjék, amelyek aminosavakból állnak.
A zsírsavak és zsírsavszármazékok a karbonsavak másik csoportját alkotják, amelyek jelentős szerepet játszanak a biológiában. Ezek hosszú szénhidrogénláncokat és az egyik végén karbonsavcsoportot tartalmaznak. Szinte minden élőlény sejtmembránja elsősorban foszfolipid kettősrétegből áll, amely hidrofób zsírsavláncokból és poláros, hidrofil foszfát "fej" csoportokból álló micellákból áll.
Az emberekben és sok más állatban a sósav a gyomorban kiválasztódó gyomorsav része. Segíthet a fehérjék és poliszacharidok hidrolizálásában. Az inaktív proenzimet, a pepszinogént is képes pepszin enzimmé alakítani. Egyes élőlények védekezés céljából termelnek savakat; például a hangyák hangyasavat, a polipok pedig magneta nevű fekete savat.
A legtöbb sav megtalálható a természetben. Ezek közül néhány a következő:
- Az ecet valószínűleg az egyik legismertebb; ecetsavat tartalmaz, ami a jól ismert ízét adja.
- A salétromsav, NHO3 körülbelül a 13. század óta ismert.
- A citromsav, C 6H8 O7 sokféle gyümölcsben megtalálható. Valószínűleg Geber fedezte fel őket a 8. században.
- A tejsavat, C 3H6 O-t3 Carl Wilhelm Scheele találta meg 1780-ban. A savanyú tejtermékekben, például a joghurtban található meg.
- A kénsavat, a H2 SO-t4 valószínűleg Geber fedezte fel. Ma az akkumulátorokban található meg.
Kapcsolódó oldalak
- Lúg
- Folsav
Kérdések és válaszok
K: Mi az a SAV?
V: Az ACID az adatbázisok bizonyos tulajdonságairól szóló cikk.
K: Mi a sav általában?
V: A sav általában olyan anyag, amely képes hidrogéniont (H+) adni egy másik anyagnak, és amelynek pH-ja 7,0-nál kisebb.
K: Milyen feltételek mellett képes egy vegyi anyag protont adni?
V: Egy vegyi anyag akkor tud protont adni, ha a hidrogénatom egy elektronegatív atomhoz, például oxigénhez, nitrogénhez vagy klórhoz kapcsolódik.
K: Mi a különbség az erős és a gyenge savak között?
V: Az erős savak elengedik az összes protonjukat, míg a gyenge savak megtartanak néhányat. A molekulánként felszabaduló ionok mennyisége határozza meg, hogy a sav gyenge vagy erős.
K: Milyen pH-tartományban vannak a gyenge és az erős savak?
V: A gyenge savak pH-értéke általában 4-6, míg az erős savaké 1-3 közötti.
K: Mi az a bázis?
V: A bázis a sav "kémiai ellentéte". A bázis olyan anyag, amely befogadja a sav hidrogénatomját. A bázisok olyan molekulák, amelyek vízben képesek szétválni és hidroxidionokat szabadítani.
K: Mi az LSD?
V: Az LSD (lizergsav-dietilamid) egy kábítószer, amelyet néha savként emlegetnek, de nem kapcsolódik az ebben a cikkben említett savhoz.
Keres