Akkumulátor: működés, típusok (elsődleges és újratölthető)
Ismerd meg az akkumulátor működését, az elsődleges és újratölthető típusok előnyeit, élettartamát és helyes használatát elektromos eszközökben.
Az akkumulátor kémiai reakció révén alakítja át a kémiai energiát elektromos energiává. A vegyi anyagokat általában az akkumulátor belsejében tartják. Egy áramkörben más alkatrészek áramellátására használják. Az akkumulátor egyenáramot (DC) termel (az áram egy irányba áramlik, és nem változik oda-vissza).
Az épületben lévő konnektorból származó áram használata olcsóbb és hatékonyabb, de egy akkumulátor olyan területeken is képes áramot szolgáltatni, ahol nincs elektromos áramelosztás. Ez olyan mozgó dolgok esetében is hasznos, mint például az elektromos járművek és a mobiltelefonok.
Az akkumulátorok lehetnek elsődlegesek vagy másodlagosak. Az elsődlegeset kidobják, amikor már nem tud áramot szolgáltatni. A másodlagos feltölthető és újra felhasználható.
Hogyan működik röviden
Az akkumulátor két vagy több elektródából (anód és katód) és egy elektrolitból áll. Kisüléskor kémiai reakciók során elektronok szabadulnak fel az egyik elektródon, amelyek a külső áramkörön keresztül a másik elektród felé áramlanak, így hoznak létre áramot. Töltéskor (ha a cella újratölthető) külső energia visszaforgatja a reakciót, és a vegyi anyagok eredeti állapotukba kerülnek.
Fontos jellemzők
- Feszültség: egy cella névleges feszültsége kémiai összetételtől függ (pl. alkálielem ~1,5 V, lítium-ion cella ~3,6–3,7 V, ólom-savas ~2 V/cella).
- Kapacitás: általában mAh vagy Ah-ban mérik; ez mutatja, hogy adott áram mellett mennyi ideig képes működni.
- Energiadenzitás: mennyi energia jut tömeg- vagy térfogategységre — fontos mobil eszközöknél és járműveknél.
- Teljesítmény (power density): milyen gyorsan képes leadni az energiát — fontos például indítási akkumulátoroknál.
- Belső ellenállás: minél kisebb, annál kevésbé csökken a feszültség nagy áramnál.
- Önkisülés: az akkumulátor idővel, használat nélkül is veszít töltéséből; a mértéke kémiai típusonként változik.
- Élettartam / ciklusszám: újratölthető akkumulátorok esetén hány töltés–kisülés ciklust bírnak érdemi teljesítményvesztés nélkül.
Típusok részletesebben
Elsődleges (nem tölthető) cellák:
- Alkáli (általános háztartási elemek): olcsók, nagy kapacitás mérsékelt áramhoz, egyszer használatosak.
- Lítium-primer: magasabb feszültség és energiadenzitás, hosszú eltarthatóság, gyakran használják például óra, távadó és egyes kis eszközökben.
- Cink–szén: régebbi, olcsó megoldás alacsonyabb kapacitással.
Másodlagos (tölthető) akkumulátorok:
- Ólom-savas: olcsó, nagy indítóáramot ad (autóindító akkumulátorok), de nehéz és alacsony energiadenzitású.
- Nikkel-kadmium (NiCd): jó teljesítmény hidegben és nagy ciklusszám, de kadmium miatt környezetszennyező; napjainkban ritkább.
- Nikkel-metál-hidrid (NiMH): jobb kapacitás, kevésbé mérgező, gyakran AAA/AA tölthető elemekben.
- Lítium-ion (Li-ion) és lítium-polimer (LiPo): nagy energiadenzitás, könnyű, népszerű mobiltelefonokban, laptopokban és elektromos járművekben; speciális töltésvédelmet igényelnek.
Töltés, töltésvédelem és karbantartás
- Töltéskor fontos a megfelelő töltési algoritmus (például CC-CV — állandó áram, majd állandó feszültség Li-ion esetén), különben csökken az élettartam vagy veszélyes helyzet alakulhat ki.
- Néhány típusnál (NiCd) előfordul a memóriahatás — ismétlődő részleges töltések után csökken a hasznos kapacitás; a NiMH és Li-ion kevésbé érzékeny erre.
- Tárolásnál ajánlott hűvös, száraz helyen tartani az akkumulátort, és a hosszú távú tároláshoz részleges töltöttségi szintet (gyártói ajánlás szerint, pl. ~40–60% Li-ionnál) javasolt fenntartani.
Biztonság és környezetvédelem
A töltés, túlmelegedés, rövidzárlat vagy mechanikai sérülés veszélyes reakciókat okozhat (tűz, robbanás, mérgező gázok). Lítium-alapú akkumulátoroknál különösen fontos a védelmi elektronikával (BMS) ellátott töltés és védőáramkör használata. Sérült vagy megduzzadt cellát soha ne használjunk tovább.
Környezeti szempontból az akkumulátorok anyagai — különösen a nehézfémek és vegyületek — károsak lehetnek, ezért fontos a szelektív gyűjtés és az újrahasznosítás. Sok országban törvény írja elő az elhasznált akkumulátorok visszagyűjtését és kezelését.
Újrahasznosítás és selejtezés
Az akkumulátorok újrahasznosítása visszanyeri az értékes anyagokat (pl. lítium, kobalt, nikkel, ólom), és csökkenti a környezeti terhelést. Soha ne dobjuk őket háztartási szemétbe: vigyük az erre kijelölt gyűjtőpontokra vagy vissza a kereskedőhöz, aki gyakran vállalja a leadást.
Összefoglalás
Az akkumulátorok alapvető szerepet játszanak a hordozható és távoli energiaellátásban. Választáskor figyelembe kell venni az alkalmazást, a szükséges energiasűrűséget, ciklusélettartamot, költséget és környezeti hatásokat. A helyes használat, tárolás és újrahasznosítás hosszabb élettartamot és kisebb környezeti kárt eredményez.

Egy akkumulátor sematikus szimbóluma
A kémia az akkumulátor belsejében
Az akkumulátor lehet egy vagy több cellás. Minden cellának van egy anódja, katódja és elektrolitja. Az elektrolit a fő anyag az akkumulátor belsejében. Ez gyakran egyfajta sav, és veszélyes lehet az érintésre. Az anód az elektrolittal reakcióba lépve elektronokat termel (ez a negatív vagy - vég). A katód reakcióba lép az elektrolittal, és elektronokat vesz fel (ez a pozitív vagy + vég). Elektromos áram akkor keletkezik, amikor egy vezeték összeköti az anódot és a katódot, és az elektronok az egyik végéről a másikra mozognak. (De egy akkumulátort pusztán a két végét összekötő vezeték is károsíthatja, ezért a két vég között egy terhelésre is szükség van. A terhelés olyan valami, ami lelassítja az elektronokat, és általában valami hasznosat csinál, mint például egy villanykörte egy zseblámpában, vagy az elektronika egy számológépben).Az elektrolit lehet folyékony vagy szilárd. Az akkumulátort az elektrolit típusától függően nedves cellás vagy száraz cellás akkumulátornak nevezik.
Az akkumulátorban lejátszódó kémiai reakciók exoterm reakciók. Az ilyen típusú reakciók hőtermeléssel járnak. Ha például hosszú ideig bekapcsolva hagyja a laptopját, majd megérinti az akkumulátort, az meleg vagy forró lesz.
Az újratölthető akkumulátor az akkumulátorban lejátszódó kémiai reakció megfordításával töltődik fel. Az újratölthető akkumulátor azonban csak meghatározott számú alkalommal tölthető újra (újratöltési élettartam). Még a beépített akkumulátorokat sem lehet örökké újratölteni. Ráadásul minden egyes újratöltéskor az akkumulátor töltésmegtartó képessége egy kicsit csökken. A nem újratölthető akkumulátorokat nem szabad tölteni, mivel különböző káros anyagok szivároghatnak ki, például kálium-hidroxid.
A cellák összekapcsolhatók, hogy nagyobb akkumulátort alkossanak. Ha az egyik cella pozitívját a következő cella negatívjához kapcsoljuk, akkor sorba kapcsoljuk őket. Az egyes elemek feszültségét összeadjuk. Két hatvoltos akkumulátor sorba kötve 12 voltot ad.
Ha az egyik cella pozitívját a másik cella pozitívjával, a negatívját pedig a negatívjával kapcsoljuk össze, azt párhuzamos kapcsolásnak nevezzük. A feszültség ugyanaz marad, de az áram összeadódik. A feszültség az a nyomás, amely az elektronokat a vezetékeken keresztül nyomja, ezt feszültségben mérik. Az áram az, hogy hány elektron tud egyszerre menni, ezt amperben mérik. Az áram és a feszültség kombinációja az akkumulátor teljesítménye (watt = volt x amper).
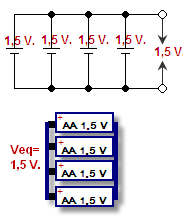
Párhuzamosan kapcsolt akkumulátorok - vázlatosan és rajzban ábrázolva
Akkumulátor méretek
Az akkumulátorok sokféle formában, méretben és feszültségben léteznek.Az AA, AAA, C és D elemek, beleértve az alkáli elemeket is, szabványos méretűek és formájúak, és körülbelül 1,5 voltos feszültségűek. A cellák feszültsége a felhasznált vegyi anyagoktól függ. Az általa szolgáltatható elektromos töltés attól függ, hogy mekkora a cella, valamint attól, hogy milyen vegyi anyagokat tartalmaz. Az akkumulátor által szolgáltatott töltést általában amperórában mérik. Mivel a feszültség nem változik, a nagyobb töltés azt jelenti, hogy egy nagyobb cella több amperórát tud szolgáltatni, vagy hosszabb ideig üzemel.
Történelem
Az első akkumulátort feltalálták 1800 Alessandro Volta találta fel. Napjainkban az ő akkumulátorát nevezik Volta-akkumulátornak.A kis, modern akkumulátorokban a folyadékot egyfajta paszta formájában rögzítik, és mindent egy zárt tokba tesznek. Ennek a toknak köszönhetően semmi sem tud kifolyni az akkumulátorból. A nagyobb akkumulátorokban, például az autóakkumulátorokban még mindig van folyadék, és nem zártak. A II. világháború alatt találták fel azt a fajta akkumulátort, amely olvasztott sókat használ elektrolitként.
Az akkumulátorok típusai
- Száraz cellák, olyan cellák, amelyek nem tartalmaznak folyadékot (vagy immobilizált folyadékot, például pasztát vagy gélt) elektrolitként.
- Elsődleges cella, nem újratölthető cellák
- Alkalikus elem, "alkáli", nem újratölthető
- Higany akkumulátor, nem újratölthető
- Leclanche akkumulátor, "super heavy duty", nem újratölthető
- Lítium akkumulátor, nem újratölthető, "érmecella"
- Ezüst-oxid elem, nem újratölthető, óraelem
- Voltaic halom, Allesandro Voltas első akkumulátora
- Másodlagos cella, újratölthető cellák
- Zárt ólomsavas akkumulátor
- Lítium-ion akkumulátor, újratölthető, mobiltelefonokban és laptopokban használatos
- Nikkel-kadmium akkumulátor, "NiCd", újratölthető
- Nikkel-fém-hidrid akkumulátor, "NiMH", újratölthető
- Nikkel-cink akkumulátor
- Nedves cellák, olyan cellák, amelyek elektrolitként folyadékot tartalmaznak.
- Ólomsavas akkumulátor, újratölthető, autó akkumulátor
- Nikkel-vas akkumulátor, újratölthető, Edison-akkumulátor
- Üzemanyagcella, üzemanyag hozzáadásával feltöltve

Az autó akkumulátor felülnézetből
Az akkumulátorok alternatívái
Az üzemanyagcellák és a napelemek nem akkumulátorok, mivel nem tárolják az energiát magukban.A kondenzátor nem akkumulátor, mert nem tárolja az energiát kémiai reakcióban. A kondenzátor képes tárolni az áramot, és sokkal gyorsabban tud áramot termelni, mint egy akkumulátor, de általában túl sokba kerül, hogy olyan nagy legyen, mint egy akkumulátor. A tudósok és a vegyészmérnökök azon dolgoznak, hogy jobb kondenzátorokat és akkumulátorokat készítsenek az elektromos autók számára.
A kézzel és lábbal működtetett kis elektromos generátorok kis elektromos eszközökben szolgáltatnak áramot. Az óraműves rádiók, óraműves zseblámpák és hasonló készülékek is rendelkeznek felhúzható rugóval a mechanikus energia tárolására.
Kérdések és válaszok
K: Mi az az akkumulátor?
V: Az akkumulátor olyan eszköz, amely kémiai reakció révén kémiai energiát alakít át elektromos energiává.
K: Hogyan állít elő egy akkumulátor elektromos áramot?
V: Az akkumulátor egyenáramot (DC) termel, amely egy irányban áramlik, és nem változik oda-vissza.
K: Hol tartják a vegyi anyagokat az akkumulátorban?
V: A vegyi anyagokat általában az akkumulátor belsejében tartják.
K: Mi a különbség az elsődleges és a másodlagos akkumulátor között?
V: Az elsődleges akkumulátort kidobják, amikor már nem tud áramot szolgáltatni, míg a másodlagos akkumulátor újratölthető és újrafelhasználható.
K: Miért hasznosak az akkumulátorok?
V: Az akkumulátorok hasznosak az áramellátás biztosítására olyan területeken, ahol nincs elektromos áramelosztás, valamint olyan mozgó dolgok esetében, mint például az elektromos járművek és a mobiltelefonok.
K: Olcsóbb és hatékonyabb az épületben lévő konnektorból származó áram használata, mint az akkumulátor használata?
V: Igen, az épületben lévő konnektorból származó áram használata olcsóbb és hatékonyabb, mint az akkumulátor használata.
K: Milyen típusú villamos energiát termel az akkumulátor?
V: Az akkumulátor egyenáramú (DC) áramot termel.
Keres