A keletróp reakciók a
A keletróp reakciók a periciklusos reakciók egy típusa, ahol az egyik reagens egyik atomja két új kötést kap. A periciklusos reakció olyan reakció, amelyben az atomok ciklikus sorozata és a kölcsönhatásba lépő orbitálisok kapcsolódó ciklikus sorozata egy átmeneti állapotot alkot. Ebben a ciklikus tömbben a σ- és π-kötések átrendeződése történik.
A keletrópikus reakciók a cikloaddíciók egy alosztálya. A keletrópikus reakciókat az különbözteti meg, hogy az egyik reagensnél mindkét új kötés ugyanahhoz az atomhoz kapcsolódik. Az 1. ábrán jobbra néhány példa látható. Az első esetben az egyetlen atom a karbonilcsoport szénatomja. Ez a szénatom a szén-monoxidban végződik. A végeredmény két új kötést hoz létre egy atomhoz. Az első két példát "keletrópikus extrakciónak" nevezik, mivel a reakció során egy kis stabil molekula keletkezik. E reakciók mozgatórugója gyakran a gáz (pl. CO vagy N2) felszabadulásából származó entrópikus előny.

1. ábra. Periciklusos reakciók
Elméleti elemzés
A keletróp reakciókban részt vevő molekulák geometriája miatt ezek a reakciók megerősítik az elméleti kémikusok számos előrejelzését. A keletrópikus reakciók megerősítik a molekuláris orbitális szimmetria megőrzését.
A periciklusos átmeneti állapotban egy kis molekula két elektront ad a gyűrűnek. A reakciót két lehetséges geometria magyarázhatja. A kis molekula lineáris vagy nem lineáris módon közelíthet. A lineáris megközelítésben a kis molekula orbitáljának elektronjai közvetlenül a nagy molekula π-rendszerére irányulnak. A nemlineáris megközelítésben az orbitális kissé eltolt szögben közelít. A π-rendszerek forgási képessége a kis molekula közeledésekor döntő fontosságú az új kötések kialakításában. A forgás iránya attól függően változik, hogy hány π-elektron van a rendszerben. Az alábbiakban egy négyelektronos π-rendszerhez közelítő kételektronos töredék diagramja látható a határmolekuláris pályák segítségével. A forgás diszrotációs lesz, ha a kis molekula lineárisan közelít, és konrotációs, ha a molekula nem lineárisan közelít. A diszrotatorikus és konrotatorikus megmondja, hogy a π-rendszerben lévő kötések hogyan forognak. A disrotatorikus ellentétes irányt jelent, míg a konrotatorikus azonos irányt. Ezt mutatja az alábbi ábra is.
A Huckel-szabály segítségével megállapítható, hogy a π-rendszer aromás vagy antiaromás. Ha aromás, akkor a lineáris megközelítések diszrotációs mozgást, míg a nemlineáris megközelítések konrotációs mozgást alkalmaznak. Az antiaromás rendszer esetében ez éppen fordítva van. A lineáris megközelítések konrotatorikus mozgást, míg a nemlineáris megközelítések diszrotatorikus mozgást alkalmaznak.
Keletropikus reakciók SO2
Termodinamika
Amikor a kén-dioxid reakcióba lép butadiénnel és izoprénnel, két különböző termék keletkezik. A reakciómechanizmus határozza meg, hogy mi keletkezik. Egy kinetikus és egy termodinamikai termék is lehetséges. A termodinamikai termékből több keletkezik, mint a kinetikai termékből. A kinetikus termék Diels-Alder reakcióból származik, míg a keletróp reakció során termodinamikailag stabilabb termék keletkezik. A keletrópiás útvonalat azért használják többet, mert stabilabb öttagú gyűrűs adduktot hoz létre. Az alábbi séma mutatja a két termék közötti különbséget. A bal oldali útvonal a termodinamikai terméket, míg a jobb oldali útvonal a kinetikai terméket mutatja. Suarez és Sordo ezt 1995-ben mutatta ki. Kísérletekkel és Gauss-számításokkal is kimutatták ezt.
Kinetika
Ennek egyik példája az 1,3-diének kén-dioxiddal történő keletrópikus reakciója. A kémikusok alaposan megvizsgálták ennek a reakciónak a kinetikáját. Isaacs és Laila 1976-ban megmérte a kén-dioxid butadiénszármazékokhoz való hozzáadásának kénetikai tényezőit. Az addíció sebességét 30 °C-on benzolban követték nyomon, kezdeti hússzoros diénfelesleggel. Spektrofotométerrel vizsgálták a fényt 320 nm-en, hogy mérjék az SO2 eltűnését. A reakció "pszeudo elsőrendű kinetikát" mutatott. A kémikusok megállapították, hogy a diénen lévő elektronelvonó csoportok csökkentették a reakció sebességét. Emellett a reakció sebességét jelentősen befolyásolták a 2-szubsztituensek sztérikus hatásai is, a terjedelmesebb csoportok növelték a reakció sebességét. (Más szóval, minél nagyobb volt a második szénatomról lelógó atomcsoport, annál gyorsabban zajlott a reakció.) A szerzők ezt annak tulajdonítják, hogy a terjedelmes csoportok hajlamosak a dién ciszoid konformációját előnyben részesíteni, ami a reakcióhoz elengedhetetlen (lásd az alábbi táblázatot). Ezen kívül hét dén esetében négy hőmérsékleten mértek sebességet. Ezekből a mérésekből a kémikusok az Arrhenius-egyenlet segítségével kiszámították az egyes reakciók aktiválási entalpiáját (ΔH‡) és aktiválási entrópiáját (ΔS‡). Ez volt az egyik első fontos kísérlet a keletróp reakció kenetikájának tanulmányozására.
| -Butadién | 104 k /perc−1 (30 °C) (± 1-2%) abszolút | 104 k /perc−1 (30 °C) (± 1-2%) relatív | ΔH‡ /kcal mol−1 | ΔS‡ /cal mol −1K −1 |
| 2-metil | 1.83 | 1.00 | 14.9 | -15 |
| 2-etil | 4.76 | 2.60 | 10.6 | -20 |
| 2-izopropil | 13.0 | 7.38 | 12.5 | -17 |
| 2-terc-butil | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentil | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-brometil | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolil | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenil | 17.3 | 9.45 | N/A | N/A |
| 2-(p-bromofenil) | 9.07 | 4.96 | N/A | N/A |
| 2,3-dimetil | 3.54 | 1.93 | 12.3 | -18 |
| cisz-1-metil | 0.18 | 0.10 | N/A | N/A |
| transz-1-metil | 0.69 | 0.38 | N/A | N/A |
| 1,2-dimetilén-ciklohexán | 24.7 | 13.5 | 11.4 | -16 |
| 2-metil-1,1,4,4,4-d4 | 1.96 | N/A | N/A | N/A |
Monnat, Vogel és Sordo 2002-ben megmérték a kén-dioxid 1,2-dimetilidén-cikloalkánokhoz való hozzáadásának kinetikáját. Azt írták, hogy az 1,2-dimetilidén-ciklohexán reakciója kén-dioxiddal a reakció körülményeitől függően két különböző terméket eredményezhet. A reakció kinetikai irányítás mellett (≤ -60 °C) hetero-Diels-Alder reakcióval hozza létre a megfelelő szultint, termodinamikai irányítás mellett (≥ -40 °C) azonban keletróp reakcióval hozza létre a megfelelő szulfolént. A hetero-Diels-Alder-reakció aktiválási entalpiája körülbelül 2 kcal/mollal kisebb, mint a megfelelő keletróp reakcióé. A szulfolén CHCl/SO222 oldatban körülbelül 10 kcal/mol-lal stabilabb, mint az izometrikus szultin.
A szerzők kísérletileg ki tudtak dolgozni egy 261,2 K hőmérsékleten érvényes sebességtörvényt az 1,2-dimetilidén-ciklohexán és kén-dioxid reakciójára a megfelelő szulfolén előállításához. A reakció az 1,2-dimetilidén-ciklohexánban elsőrendű, a kén-dioxidban azonban másodrendű volt (lásd alább). Ez megerősítette az elméleti kémikusok magas szintű ab initio kvantumszámításokon alapuló előrejelzését. A szerzők számítási módszerek segítségével javasoltak egy átmeneti szerkezetet az 1,2-dimetilidén-ciklohexán és kén-dioxid keletróp reakciójára (lásd a jobb oldali ábrát). A reakció másodrendű a kén-dioxidban, mert valószínűleg egy másik kén-dioxid-molekula kötődik az átmeneti állapothoz, hogy segítsen stabilizálni azt. Hasonló eredményekre jutott Suarez, Sordo és Sordo 1995-ös tanulmánya is, amely ab initio számításokat használt a kén-dioxid és az 1,3-diének reakciójának kinetikai és termodinamikai szabályozásának vizsgálatára.
d [ ]3 d t = k [2 ] 1[ S O ] 2{\displaystyle2 {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}}
Az oldószer hatása
A 3,4-dimetil-2,5-dihidrotiofen-1,1-dioxid (jobbra látható) keletróp reakciójának oldószer hatását 14 oldószerben vizsgálták kinetikusan. Az előre- és a hátrameneti reakció reakciósebességi állandói az egyensúlyi állandókon kívül lineárisan korreláltak az ET(30) oldószer polaritási skálával.
A reakciókat 120 °C-on végeztük, és a reakcióelegyet 1H-NMR spektroszkópiával vizsgáltuk. Megállapítottuk, hogy a k1 előrehaladási sebesség 4,5-szeresére csökken a ciklohexánról a metanolra. A fordított k-1 sebesség 53-szorosára nőtt a ciklohexánról a metanolra, míg a K egyensúlyi állandó 140-szeresére eqcsökkent. Az egyensúlyi és kinetikai adatok közötti összefüggések azt mutatják, hogy az aktiválási folyamat során a polaritás megváltozik. A szerzők szerint úgy tűnik, hogy a reakciót befolyásolja az oldószer polaritása, és ezt a dipólusmomentumok változásával lehet kimutatni, amikor a reaktánsból az átmeneti állapotból a termékbe lépünk. A szerzők azt is megállapítják, hogy a keletróp reakciót látszólag nem befolyásolja sem az oldószer savassága, sem bázicitása.
A tanulmány eredményei alapján a szerzők a következő magatartásformákat várják:
1. Az oldószer polaritásának változása kevésbé befolyásolja a sebességet, mint az egyensúly.
2. A sebességállandókra a polaritás ellentétes hatása lesz jellemző: az ET(30) növekedésével a k1 kissé csökken, a k-1 pedig azonos feltételek mellett nő.
3. A k-ra-1 gyakorolt hatás nagyobb lesz, mint a k-ra1.

1,2-dimetilidén-ciklohexán és SO2 reakciója kinetikusan szabályozott hetero-Diels-Alder reakcióval szultint vagy termodinamikusan szabályozott keletrópikus reakcióval szulfolént eredményez.

Javasolt átmeneti állapot az 1,2-dimetilidén-ciklohexán és SO2 reakciójához, hogy szulfolén keletkezzen keletróp reakcióval
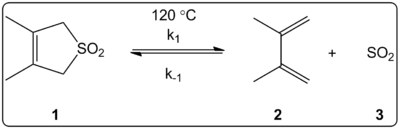
Különböző oldószerekben vizsgált keletrópikus reakció
Karbénaddíciók alkénekhez
Az egyik szintetikusan legfontosabb keletrópikus reakció egy szingulett-karén adalékolása egy alkénhez ciklopropán előállítására (lásd a bal oldali ábrát). A karbén olyan semleges molekula, amely egy kétértékű szenet tartalmaz, amelynek valenciahéjában hat elektron található. Emiatt a karbének erősen reaktív elektrofilek, és reakcióközéptermékként keletkeznek. A szingulett karben egy üres p orbitált és egy nagyjából sp 2hibrid orbitált tartalmaz, amely két elektronnal rendelkezik. A szinglet-karbenek sztereospecifikusan adódnak alkénekhez, és az alkén sztereokémiája megmarad a ciklopropán termékben. Egy karén alkénhez történő addíciójának mechanizmusa egy összehangolt [2+1] cikloaddíció (lásd az ábrát). Kloroformból vagy brómoformból származó karbénekkel CX2 adható egy alkénhez, így dihalociklopropán keletkezik, míg a Simmons-Smith-reagens CH-t2 ad hozzá.
A kitöltött karén-orbitál kölcsönhatása az alkén π rendszerével négyelektronos rendszert hoz létre, és kedvez a nem lineáris megközelítésnek. Ugyancsak kedvező a karén üres p-orbitáljának keveredése a töltött alkén π-orbitáljával. A kedvező keveredés nemlineáris megközelítéssel történik (lásd a 2. ábrát jobbra). Bár az elmélet egyértelműen a nemlineáris megközelítést részesíti előnyben, a lineáris és a nemlineáris megközelítésnek nincsenek nyilvánvaló kísérleti következményei.

Karbén adalékolása alkénhez ciklopropán képzése céljából

2. ábra. A) A szinglet-karbének orbitáljai B) A) a) a karbén sp-orbitál2 és b) a karbén p-orbitál nem-lineáris megközelítése
Kérdések és válaszok
K: Mi az a cseletropikus reakció?
V: A keletróp reakció a periciklusos reakciók egy típusa, ahol az egyik reagens egyik atomja két új kötést kap.
K: Mi az a periciklusos reakció?
V: A periciklusos reakció olyan átmeneti állapotot jelent, amelyben az atomok ciklikusan elhelyezkedő sorozata és a kölcsönhatásba lépő orbitálisok kapcsolódó ciklikus sorozata van jelen, és amelyben a َ és ً kötések átrendeződnek.
K: Miben különbözik más típusú reakcióktól?
V: A keletrópikus reakciók a cikloaddíciók egy alosztálya, és az különbözteti meg őket a többi reakciótípustól, hogy az egyik reagensnél mindkét új kötés ugyanahhoz az atomhoz kapcsolódik.
K: Melyek a példák?
V: A példák közé tartoznak a "keletrópikus extrakciók", például amikor a karbonilcsoport egyetlen atomja szén-monoxidban végződik.
K: Mi hajtja ezeket a reakciókat?
V: E reakciók mozgatórugója gyakran a gáz (pl. CO vagy N2) felszabadulásából származó entrópikus előny.
K: Az 1. ábra kapcsolódik a keletróp reakciókhoz? V: Igen, az 1. ábra a keletróp reakciókra mutat példákat.
Keres
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)