Periódusos rendszer: definíció, felépítés és a kémiai elemek áttekintése
Periódusos rendszer: világos definíció, felépítés és részletes áttekintés a kémiai elemekről — Mendelejev, csoportok, periódusok és gyakorlati példák egy helyen.
A kémiai elemek periódusos rendszere az ismert kémiai elemek rendszerezett listája, amely az elemek fő tulajdonságai és egymáshoz való viszonyuk áttekintésére szolgál. A táblázatban az elemek atomi számuk sorrendjében vannak elhelyezve, kezdve a legalacsonyabb, egyes számmal, a hidrogénnel. Egy elem atomi száma megegyezik az adott atommagban lévő protonok számával. A periódusos rendszerben az elemek periódusokba és csoportokba vannak rendezve: a vízszintes sorokat periódusoknak, a függőleges oszlopokat pedig csoportoknak nevezzük.
Periódusok és csoportok — hogyan kell olvasni a táblázatot
Minden periódusban az elemek egymást követő atomi szám szerint helyezkednek el. A jelenleg ismert elemek a 1–7. periódusokban találhatók; a 8. periódusban elméleti és még nem stabil, szintetikus elemek lehetségesek. Az 1. periódusból csak két elem áll: a hidrogén és a hélium. A 2. és 3. periódusokban mindegyikben 8-8 elem található, a középső periódusok (különösen a 4. és 5.) hosszabbak, mert több elektronhéj és alhéj töltődik fel.
Az elemek egy oszlopa a táblázatban csoport. A standard periódusos rendszer 18 csoportból áll, melyeket az IUPAC ma arab számokkal (1–18) számoz. Az egy csoportba tartozó elemek elektronjai hasonló módon rendeződnek, különösen az értékelektronok száma szerint, ami hasonló kémiai tulajdonságokat eredményez. Például a 18-as csoport a nemesgázoknak felel meg: ezek atomok általában gázhalmazállapotúak és kémiai reakciókban tompák (kevésbé reagálnak).
Főbb elemosztályok és jellegzetes csoportok
- Alkáli fémek (1. csoport) — nagyon reakcióképes fémek (kivéve a hidrogén különleges esetét); lágyak és könnyen oxidálódnak.
- Alkáli földfémek (2. csoport) — szintén reaktív fémek, de kevésbé, mint az alkáliak.
- Átmenetifémek (3–12. csoport) — jól vezetnek hőt és elektromosságot, sokféle oxidációs állapotot mutatnak; fontos ipari katalizátorok.
- Halogének (17. csoport) — nagyon reaktív nemfémek, erősen elektronvonzóak.
- Nemesgázok (18. csoport) — kémiailag legkevésbé reaktív elemek.
A táblázatban található elemek nagyobb csoportosítása: fémek, metalloidok és nemfémek. A fémesség általában balra lent növekszik (például a cézium nagyon fémes), míg a nemfémes tulajdonságok jobbra és felfelé erősödnek (például a hélium gázként viselkedik).
Elektronkonfiguráció és a periódusosság oka
A periódusos rendszer ismétlődő mintázatai (periodicitás) az elektronok elhelyezkedéséből származnak: különösen az elektronhéjak és alhéjak feltöltődéséből. Az elemek helye megmutatja, hány elektron töltődik az adott külső héjra (értékelektronok), ez határozza meg kémiai viselkedésüket. A táblázat blokkokra bontható (s-, p-, d-, f-blokk) az alapján, melyik alhéj töltődik fel éppen.
Periodikus trendek
- Atomsugár: általában balról jobbra csökken (nagyobb vonzóerő a mag részéről), fentről lefelé nő (több elektronhéj).
- Ionizációs energia: az az energia, amely egy elektront eltávolít; általában balról jobbra nő, fentről lefelé csökken.
- Elektronegativitás: az atom más atom elektronjainak vonzása; balról jobbra általában nő, fentről lefelé csökken.
Ritkaföldfémek, lantanoidok és aktinoidok
A táblázat alján gyakran külön sorokban találjuk a lantanoidokat és aktinoidokat (az úgynevezett f-blokk elemei). Ezek a ritkaföldfémek és megfelelőik fontos szerepet játszanak a modern technológiákban (mágnesek, katalizátorok, nukleáris reaktorok).
Történet és jelentőség
A periódusos rendszert a Dmitrij Ivanovics Mendelejev (1834–1907) orosz kémikus fejlesztette ki. Mendelejev az elemeket akkor még részben ismert tulajdonságaik és rendezett atomtömegeik alapján helyezte el, és a táblázatába üres helyeket hagyott olyan elemek számára, amelyeket még nem ismertek — ezzel később pontosan megjósolta több ismeretlen elem tulajdonságait. Később Henry Moseley kimutatta, hogy az atomok rendezése helyes alapja az atomi szám (protonok száma), nem pedig csupán az atomtömeg, ami tovább pontosította a táblázatot.
Az IUPAC 1990-ben hivatalosan is elfogadta a ma használt, arab számokkal jelölt csoportszámozást, ezzel kiváltva a korábbi római számokkal és eltérő jelölésekkel dolgozó rendszereket. Az elemek közül ma már több szintetikus, rövid élettartamú, nehéz (szupernehéz) elem is ismert; például a 101-es rendszámú elemnek Mendelejev után a mendelevium nevet adták.
Gyakorlati alkalmazások és olvasási tippek
A periódusos rendszer ismerete segít megérteni és előre jelezni az elemek kémiai viselkedését, reakcióképességét és vegyületeik tulajdonságait. Amikor egy elemet keresünk a táblázatban, érdemes megfigyelni:
- az atomi számát (protonok száma);
- az átlagos atomtömeget (izotópok miatti érték);
- a csoportját (azonos csoport tagjai hasonló kémiai viselkedést mutatnak);
- a periódust (melyik héj töltődik éppen).
Például a hidrogén sajátos helyzetben van: bár egyes rendszerek a 1. csoporthoz sorolják, tulajdonságai egyes tekintetben a halogénekre emlékeztetnek. A cézium és más alkáli fémek erősen reagálnak vízzel, míg a hélium inert gázként stabil és szinte nem reagál.
Összefoglalás
A periódusos rendszer tehát nem csupán elemek listája: strukturált eszköz, amely megmutatja az elemek közötti rendszerszerű kapcsolatokat, kémiai viselkedésüket és trendjeiket. Mindennapi tudományos és ipari alkalmazások alapja, segítve az új anyagok felfedezését és az elemek gazdaságos, célzott felhasználását.
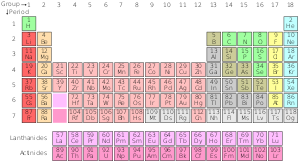
A periódusos rendszer standard variációja
Standard periódusos rendszer
| Csoport→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lantanidák | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Aktinidák | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Szuperaktinidák | |||||||||||||||||
| * Lantanid sorozat | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Aktinid sorozat | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Szuperaktinid sorozat | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Szuperaktinid sorozat | 136. | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Szuperaktinid sorozat | 151Upu | 152Upb | 153Upt | 154Upq | 155Upp | 156Uph | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Szuperaktinid sorozat | 166Uhh | 167Uhs | 168Uho | 169Uhe | 170Usn | 171Usu | 172Usb | 173Ust | 174Usq | 175Usp | 176Ush | 177Uss | 178Uso | 179Használat | 180Uon | |||||
| *** Szuperaktinid sorozat | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Szuperaktinid sorozat | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Szuperaktinid sorozat | 211Buu | 212Bub | 213De | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220 milliárd | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
A periódusos rendszer kémiai sorozatai
- Alkálifémek
- Alkáliföldfémek
- Lantanidák
- Aktinidák
- Szuperaktinidák
- Átmeneti fémek
- Szegény fémek
- Nemfémek
- Halogének
Állapot standard hőmérsékleten és nyomáson. Az elem szimbóluma feletti szám (atomszám) színe mutatja az elem állapotát normál körülmények között.
- a kék színűek a gázok
- a zöld színűek folyadékok
- a fekete színűek tömörek
- A szilárd határokkal rendelkezők stabil izotópok (őselemek)
- A szaggatott határokkal jelöltek csak radioaktív, természetes eredetű izotópokat tartalmaznak.
- A szaggatott határokkal jelöltek nem fordulnak elő a természetben (szintetikus elemek).
- a határok nélküliek túlságosan radioaktívak ahhoz, hogy még ne fedezték volna fel őket.
Egyéb módszerek a kémiai elemek megjelenítésére
A periódusos rendszer fenti változata a leggyakrabban használt. Az alábbiakban más elterjedt változatok szerepelnek:
· 
· 
Dmitrij Ivanovics Mendelejev virágos elrendezést használt; az aktinidák, lantanidák a főcsoport mellett hurokként szerepelnek.
· 
Timothy Stove az elemeket kvantumszám szerint rendezte el.
· ![]()
Betterman az elemeket izoelektromos tulajdonságaik szerint rendezte el, amelyek polinomiális formára alakíthatók.
· 
Háromszög alakú változat, Zmaczynski és Bayley által
· 
Piramis alakban elrendezve.
Kevésbé használt verziók
- A szabványos táblázat az alapokat tartalmazza. Ez a fentiekben látható
- Függőleges táblázat a jobb olvashatóság érdekében a webböngészőkben
- A nagy táblázat az alapokat és a teljes elemneveket tartalmazza.
- A hatalmas táblázat az alapokat, valamint a teljes elemneveket és atomtömegeket tartalmazza.
- Elektronkonfigurációk
- Fémek és nem fémek
- Elemek listája: tartalmazza a nevet, szimbólumot, atomi számot, atomtömeget, csoportot és periódust; ezek bármelyike alapján rendezhető.
- Az elemek listája szimbólum szerint
- Az elemek listája forráspont szerint
- Az elemek listája olvadáspont szerint
- Az elemek sűrűség szerinti listája
Kapcsolódó oldalak
- Periódusos rendszer csoport
- Periódusos rendszer periódus
- Bővített periódusos rendszer
Kérdések és válaszok
K: Mi az a periódusos rendszer?
V: A periódusos rendszer egy olyan táblázat, amely az összes ismert kémiai elemet az atomszámuk szerinti sorrendbe rendezi, kezdve a hidrogénnel az első helyen. A hasonló tulajdonságokkal rendelkező elemek gyakran egymás közelében helyezkednek el.
K: Hány periódus és csoport van a standard periódusos rendszerben?
V: A standard periódusos rendszerben 8 periódus és 18 csoport található.
K: Mi a közös az egy periódusba tartozó elemekben?
V: Az egy periódusba tartozó elemeknek egymást követő atomszámaik vannak.
K: Mi a közös a csoportokban lévő elemekben?
V: A csoportba tartozó elemeknek az elektronok hasonlóan vannak elrendezve, az értékelektronok száma szerint, ami hasonló kémiai tulajdonságokkal ruházza fel őket.
K: Ki találta ki a periódusos rendszert?
V: Dmitrij Ivanovics Mendelejev orosz kémikus (1834-1907) találta fel a periódusos rendszert.
K: Mi a periódusos rendszer három fő csoportja?
V: A periódusos rendszer három fő csoportja a fémek, a metalloidok és a nemfémek.
K: Hogyan figyelhetők meg az elemek közötti minták és kapcsolatok a periódusos rendszer segítségével?
V: Az elemek közötti minták és kapcsolatok megfigyelhetők, ha megnézzük, hol jelennek meg a periódusos rendszerben; például a bal alsó sarokban lévő elemek általában fémesebbek, mint a jobb felső sarokban lévő elemek.
Keres