Mi az a karbokation? Definíció, szerkezet és reaktivitás
Karbokation: meghatározás, sp2/sp3 szerkezet, stabilitás és reaktivitás áttekintése egyszerű magyarázatokkal és példákkal.
Karbokation alatt olyan ion-t értünk, amelyben a pozitív töltés egy szénatomon koncentrálódik. A karbokationban a töltött szénatom „szextett” állapotban van (azaz a külső valenciahéjban nyolc valenciaelektron helyett csak hat elektron található), ezért az ilyen centrumok erősen reaktívak: igyekeznek visszanyerni a semleges töltést, illetve kitölteni a hiányzó elektronokat, hogy közelebb kerüljenek az oktett-szabály szerinti stabilitáshoz.
Szerkezet és hibridizáció
Formális logika szerint a karbokationok sp3 hibridizációval rendelkeznének (egy üres sp3 orbital adná a pozitív töltést), a kísérleti és elméleti eredmények azonban azt mutatják, hogy a legtöbb karbokation inkább trigonális sík geometriájú, azaz a központi szénatom sp2 hibridizációhoz hasonlóan viselkedik: három σ-kötés síkban van, és a negyedik, üres orbital egy p-orbital, amely merőleges a síkra. Ennek következménye a karbokation planáris szerkezete és az üres p-orbital szerepe a stabilizációban (pl. rezonancia).
Stabilitás — mi tesz egy karbokationt stabilabbá?
- Hiperkonjugáció: a közeli C–H vagy C–C kötésekben lévő σ-elektronok részleges delokalizációja az üres p-orbitalba erős stabilizáló hatás. Ez különösen a tertiér karbokationokat teszi stabilabbá, ezért általában a stabilitási sorrend: methyl < elsődleges < másodlagos < harmadlagos (ha csak alkileffektusokról van szó).
- Induktív hatás: elektrondonor alkilcsoportok tolhatják az elektronokat a pozitív centrum felé, ez stabilizál.
- Rezonancia: ha a karbokation rezonálhat (például benzil- vagy allyl-karbokation), az erősen stabilizálja azt — ilyen karbokationok sokszor stabilabbak, mint egyszerű tertiér karbokationok.
- Heteroatomok hatása: oxigén, nitrogén vagy más heteroatomok pár elektronpárjával (→+M effektus) is stabilizálhatják a karbokationt.
- Oldószer- és ionpárhatások: sarki, poláris oldószerek és gyenge, stabilizált anionok tovább növelhetik a karbokation stabilitását (oldószer-közvetített stabilizáció, oldószer-sokolás), illetve a kontakt ion pair versus oldószerrel szeparált ion pair különbsége befolyásolja a reaktivitást.
Képződés és reagálási módok
Karbokationok sokféle reakcióban intermediátumként jelennek meg. Gyakoribb képződési módok:
- Heterolízis: például egy C–X (X = halogén, –OH2+ stb.) kötés heterolítikus hasadása vezet karbokationhoz (klasszikus példa: tert-butil-klorid SN1 reakciója).
- Alkén protonálása: alkének protonálásakor keletkező karbokation (pl. Brensted savak hatására) fontos lépés addíciós reakciókban.
- Eliminációs / unimolekuláris mechanizmusok (E1): az első lépés gyakran karbokation-képződés, amely utána eliminálódik.
- Elektrofil addíció: például halogénezés, hidroxilezés, amikor egy elektrofílt támadó karbokation-szerű centrumot hoz létre.
Reakciókészség és következmények
- Nukleofil befogás: a karbokationokat erős nukleofilek gyorsan megfogják és stabil termékhez vezetnek.
- Átrendeződések: hidrid- és alkilátfordulások (pl. Wagner–Meerwein átrendeződés) gyakoriak: ha egy átrendeződés stabilabb karbokationt hoz létre, azt a rendszer gyakran megvalósítja.
- Oldószer- és hőmérsékletfüggés: polaritás, protikusság és hőmérséklet jelentősen befolyásolja a karbokationok képződését és életidejét.
Speciális esetek
Rezonancia-stabilizált karbokationok: benzil- és allyl-karbokationok erősen delokalizáltak, ezért általában sokkal stabilabbak, mint egyszerű alkil-karbokationok. Nemklasszikus karbokationok: egyes karbokationok (például a 2-norbornil-karbokation) olyan delokalizált töltéseloszlást mutatnak, amelyben a pozitív töltés nem jól leírható egyetlen szénatomhoz kötve — ezek speciális, vitatott és érdekes szerkezetek a szerves kémia történetében.
Gyakorlati jelentőség és megfigyelés
Karbokationok központi szerepet játszanak sok szerves szintetikus reakcióban (pl. SN1, E1, elektrofil addíciók). Kísérleti módszerekkel — alacsony hőmérsékletű NMR, infra/UV spektroszkópia, csapdázási (trapping) kísérletek — gyakran közvetetten vagy közvetlenül lehet bizonyítani létezésüket. Elméleti számítások (kvantumkémia) szintén sokat segítenek a szerkezet és a stabilitás megértésében.
Összefoglalás
Röviden: a karbokation egy elektronhiányos, pozitív töltésű szénközpontot tartalmazó , általában planáris (sp2-szerű) intermediátum, amelyet hiperkonjugáció, rezonancia és induktív hatások befolyásolnak. Stabilitásuk és reaktivitásuk megértése alapvető a szerves reakciómechanizmusok és a szintetikus tervezés szempontjából.
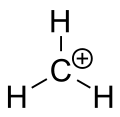
A metán karbéniumionja

tert-butil-kation, amely sík geometriát mutat
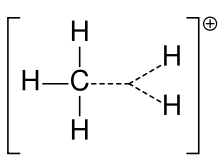
A metán karboniumionja
Definíciók
A karbokationt korábban gyakran nevezték karboniumionnak, de a kémikusok megkérdőjelezik a pontos jelentést. A mai kémiában a karbokáció bármely pozitív töltésű szénatom. Két speciális típust javasoltak: a karbéniumionok háromértékűek, a karboniumionok pedig ötértékűek vagy hatértékűek. Az egyetemi szintű tankönyvek csak úgy tárgyalják a karbokationokat, mintha azok karbéniumionok lennének, vagy a karbokationokat a régebbi karboniumion vagy karbénium- és karboniumion kifejezésre való futólagos utalással tárgyalják. Az egyik tankönyv a mai napig megmarad a karbóniumion régebbi elnevezésénél a karbéniumion esetében, és a hipervalens karbéniumion kifejezést a CH5+ számára tartja fenn.
Történelem
1891-ben G. Merling arról számolt be, hogy tropilidénhez (cikloheptatrién) brómot adott, majd a terméket felmelegítve kristályos, vízben oldódó anyagot kapott, C
7H
7Br. Nem javasolt szerkezetet; Doering és Knox azonban meggyőzően kimutatta, hogy ez tropilium (cikloheptatriénium) bromid. Ezt az iont a Hückel-szabály alapján aromássá jósolják.
1902-ben Norris és Kehrman egymástól függetlenül felfedezték, hogy a színtelen trifenil-metanol koncentrált kénsavban mélysárga oldatokat ad. A trifenilmetil-klorid hasonlóan narancssárga komplexeket képzett alumínium- és ónkloridokkal. Adolf von Baeyer 1902-ben felismerte a képződött vegyületek sószerűségét.

A szín és a sóképződés közötti kapcsolatot halokrómának nevezte el, amelynek egyik legjobb példája a malachit zöldje.
A karbokationok számos szerves reakcióban reaktív intermedierek. Ezt az elképzelést, amelyet először Julius Stieglitz vetett fel 1899-ben, Hans Meerwein fejlesztette tovább 1922-ben a Wagner-Meerwein-átrendeződésről írt tanulmányában. A karbokationok az NS1-reakcióban, az E1-reakcióban és az átrendeződési reakciókban, például a Whitmore-féle 1,2-eltolódásban is szerepet játszanak. A kémiai intézményrendszer vonakodott elfogadni a karbokation fogalmát, és az Amerikai Kémiai Társaság folyóirata sokáig elutasította az ezeket említő cikkeket.
A stabil karbokation első NMR-spektrumát oldatban Doering és munkatársai 1958-ban publikálták. Ez a heptametilbenzol-ion volt, amelyet hexametilbenzol metil-kloriddal és alumínium-kloriddal történő kezelésével állítottak elő. A stabil 7-norbornadienil-kationt Story et al. 1960-ban állította elő norbornadienil-klorid és ezüst-tetrafluoroborát reakciójával kén-dioxidban, -80 °C-on. Az NMR spektrum megállapította, hogy nem klasszikusan hidalt (az első stabil nem klasszikus ion, amelyet megfigyeltek).
1962-ben Olah közvetlenül megfigyelte a tert-butil-karbokationt, mint stabil fajt, magmágneses rezonanciával, amikor tert-butilfluoridot oldott fel mágikus savban. A norbornyil-kation NMR-ről először Schleyer és munkatársai számoltak be, és Saunders és munkatársai kimutatták, hogy egy gáton keresztül proton-zavart szenved el.
Tulajdonságok
A szerves kémiában a karbokation gyakran nukleofil támadás célpontja nukleofilek, például hidroxil- (OH-−) ionok vagy halogénionok által.
A karbokationokat az ionizált szénhez kötött szénatomok számától függően primer, szekunder vagy tercier karbokationnak minősítik. Az elsődleges karbokationoknál egy vagy nulla szénatom kapcsolódik az ionizált szénhez, a másodlagos karbokationoknál két szénatom kapcsolódik az ionizált szénhez, a harmadlagos karbokationoknál pedig három szénatom kapcsolódik az ionizált szénhez.
A karbokation stabilitása a töltést hordozó szénhez kötött alkilcsoportok számával nő. A harmadrendű karbokationok stabilabbak (és könnyebben képződnek), mint a másodrendű karbokationok; az elsődleges karbokationok nagyon instabilak, mert míg az ionizált magasabb rendű szénatomokat a hiperkonjugáció stabilizálja, a szubsztituálatlan (elsődleges) szénatomokat nem. Ezért az olyan reakciók, mint az NS1 reakció és az E1 eliminációs reakció általában nem játszódnak le, ha primer karbokation keletkezne. Kivétel ez alól, ha az ionizált szén mellett szén-szén kettőskötés van. Az ilyen kationok, mint az allil-kation CH=CH-CH22+ és a benzil-kation6 CH-CH52+ stabilabbak, mint a legtöbb más karbokation. Azok a molekulák, amelyek képesek alil- vagy benzil-karbokationokat képezni, különösen reaktívak.
A karbokationok átrendeződési reakciókat hajtanak végre kevésbé stabil szerkezetekből ugyanolyan stabil vagy stabilabb szerkezetekké, 10/sec-nál9 nagyobb sebességi állandókkal. Ez a tény számos vegyület szintetikus útját bonyolítja. Például, amikor a 3-pentanolt vizes HCl-lel hevítjük, a kezdetben keletkezett 3-pentil-karbokation átrendeződik a 3-pentil és a 2-pentil statisztikai keverékévé. Ezek a kationok a kloridionnal reagálva körülbelül 1/3-ban 3-klórpentán és 2/3-ban 2-klórpentán keletkezik.
Egyes karbokationok, mint például a norbornyil-kation, többé-kevésbé szimmetrikus háromcentrumú kötést mutatnak. Az ilyen kationokat nem klasszikus ionoknak nevezik. A "klasszikus" karbokationok és a "nem-klasszikus" izomerek közötti energiakülönbség gyakran nagyon kicsi, és a "klasszikus" és a "nem-klasszikus" szerkezetek közötti átmenetben általában kevés, vagy egyáltalán nincs aktiválási energia. A 2-butil-karbokation "nem-klasszikus" formája lényegében 2-butén, amelynek protonja közvetlenül a szén-szén kettős kötés középpontja felett helyezkedik el. A "nem klasszikus" karbokationok egykor nagy viták tárgyát képezték. George Olah egyik legnagyobb hozzájárulása a kémiához ennek a vitának a feloldása volt.
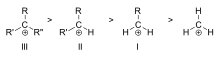
A tercier (III), szekunder (II) és primer (I) alkil-karbokationok stabilitási sorrendje
Speciális karbokationok
A ciklopropil-karbinil-kationok NMR segítségével vizsgálhatók:

A dimetilszármazék NMR-spektrumában két nem egyenértékű jelet találunk a két metilcsoportra, ami azt jelzi, hogy e kation molekuláris konformációja nem merőleges (mint az A-ban), hanem kettéosztott (mint a B-ben), az üres p-orbitál és a ciklopropil gyűrűrendszer egy síkban van:

A hajlított kötéselmélet szempontjából ez a preferencia azzal magyarázható, hogy a kitöltött ciklopropán hajlított kötések és az üres p-orbitál között kedvező orbitális átfedést feltételezünk.
Kérdések és válaszok
K: Mi az a karbokation?
V: A karbokation egy ion, amely egy pozitív töltésű szénatomot tartalmaz.
K: Mi a karbokation külső valenciahéja?
V: A karbokation külső valenciahéja a stabil nyolc valenciaelektron helyett csak hat elektronnal rendelkezik.
K: Miért reakcióképesek gyakran a karbokationok?
V: A karbokationok gyakran reaktívak, mert igyekeznek kitölteni a valenciaelektronok nyolcadát, valamint visszanyerni semleges töltésüket.
K: Mekkora a szénatomok maximális stabilitása?
V: A szénatomok maximális stabilitása akkor érhető el, ha nyolc valenciaelektronjuk van.
K: Mi az a szextett a kémiában?
V: A szextett egy olyan karbokationban lévő szénatom leírására használt kifejezés, amelynek külső valenciahéjában a stabil nyolc valenciaelektron helyett csak hat elektron van.
K: Mi a karbokation hibridizációja és molekulageometriája?
V: Bár a logika azt sugallná, hogy a karbokationok sp3 hibridizációval rendelkeznek, egy üres sp3 orbitállal, amely pozitív töltést ad, a reakcióképességük inkább az sp2 hibridizációra hasonlít, trigonális sík molekulageometriával.
K: Mi az oktett-szabály?
V: Az oktett-szabály egy elv a kémiában, amely szerint az atomok hajlamosak olyan kémiai kötéseket kialakítani más atomokkal, amelyek lehetővé teszik, hogy mindkét atomnak stabilan nyolc valenciaelektronja legyen.
Keres