Benzol (C6H6): tulajdonságok, egészségkockázatok és ipari felhasználás
Benzol (C6H6): színtelen, gyúlékony aromás vegyület — tulajdonságok, rákkeltő egészségkockázatok és ipari felhasználás (oldószer, alapanyagok).
Fizikai és kémiai tulajdonságok
- Olvadáspont: kb. 5,5 °C; forráspont: kb. 80,1 °C. - Sűrűség: ~0,88 g/cm3 (20 °C körül). - Vízben gyakorlatilag oldhatatlan (kis mértékben oldódik), jól old más szerves anyagokat. - Nagy a gőznyomása és könnyen párolog, ezért levegőben gyorsan terjed. - Kémiailag stabil aromás vegyület; tipikus reakciói közé tartozik a nitrálás, szulfonálás, halogénezés és alkilezés. Ipari előállításnál és átalakításnál fontos kiindulóvegyület.Előfordulás és ipari előállítás
A benzol természetesen is előfordul a nyersolajban, és ezért jelen van a benzinben. Ipari forrásai közé tartozik a kőolaj-finomítás és a petro-kémiai eljárások (pl. katalitikus reformálás, toluol hidro-dealkilezése). Egyes ipari folyamatok és égési folyamatok (pl. gépjármű-kipufogó, ipari égés) is kibocsátanak benzolt a levegőbe.Fő felhasználások
A benzolt széles körben használják és számos vegyipari termék alapanyagaként szolgál:- Oldószerként az iparban és laboratóriumokban, mivel jól old sok szerves anyagot (oldószer).
- Adalékanyagként és komponensként a benzinben (régebben az ólommentesítést és oktánszám növelését szolgálta).
- Kiindulóanyagként műanyagokban, gumiban és színezékekben előállítandó vegyületekhez.
- Ipari előanyag sok más fontos vegyülethez: például fenol, ciklohexán/kaprolaktám (nyersanyag műszálakhoz), styrol, anilin stb.
- Sok gyógyszer és finomkémiai termék molekuláris vázában találhatók benzolgyűrűs részletek.
Egészségkockázatok és toxikológia
A benzol rákkeltő vegyület: hosszabb idejű, tartós expozíció növeli a rákot, különösen a vérképzőszervi daganatok (pl. akut myeloid leukémia) kialakulásának kockázatát. A fő egészségügyi hatások:- Akut hatások: belégzés esetén fejfájás, szédülés, fáradékonyság, émelygés, eszméletvesztés súlyosabb expozícióban.
- Krónikus hatások: a csontvelő károsodása (leukopénia, anémia, thrombocytopenia), aplasztikus anémia, fokozott leukémia-kockázat.
- Légzési út a legfontosabb expozíciós út (belégzés), de bőrön át is felszívódhat, illetve ritkán lenyelés útján is veszélyt jelenthet.
Szabályozás és biztonság
- Nemzetközi szervezetek (pl. IARC) a benzolt emberre bizonyítottan rákkeltő anyagként sorolják be. A munkahelyi expozíciós határértékek országonként eltérnek; ezért mindig az adott ország előírásait kell követni. - Veszélyes anyagként történő tárolásnál tartsuk távol gyújtóforrásoktól, jól szellőző, hűvös helyen, eredeti, zárt edényzetben. - Tűz esetén a benzol hevesen ég — gyúlékony gázok képződhetnek; oltáshoz alkoholálló habot, száraz vegyszert vagy szén-dioxidot használjanak, és a tűzoltást képzett személyzet végezze.Környezetre gyakorolt hatás
A benzol illékony, ezért a levegőbe kerülve gyorsan eloszlik, de lokálisan légszennyezést és szagproblémákat okozhat. Talajba vagy talajvízbe jutva hosszabb ideig szennyező forrás lehet; egyes mikroorganizmusok képesek lebontani, de a környezeti tisztítás gyakran költséges. A kibocsátások csökkentése és a szivárgások megelőzése fontos a környezetvédelem szempontjából.Elsősegély és teendők expozíció esetén
- Belégzés: friss levegőre vinni az érintettet, szükség esetén orvosi ellátás. Súlyos légzési nehézség vagy eszméletvesztés esetén hívjuk a mentőket. - Bőrkontaktus: a szennyezett ruhát levenni, az érintett bőrfelületet bő vízzel és szappannal alaposan lemosni. - Szembe kerülés: öblítés bő vízzel legalább 10–15 percig, orvosi vizsgálat. - Lenyelés: orvosi ellátás szükséges; hánytatni nem szabad, ha a beteg eszméleténél van. Összefoglalva: a benzol fontos ipari alapanyag, de jelentős egészség- és környezetkárosító hatásokkal jár. Munkahelyi és ipari körülmények között a kitettség szigorú szabályozást, műszaki intézkedéseket és személyi védelmet igényel annak érdekében, hogy minimalizáljuk a rövid- és hosszú távú kockázatokat._1964,_MiNr_440.jpg)
1964-ben a német posta bélyeget bocsátott ki a benzol 100 éves felfedezésének emlékére.
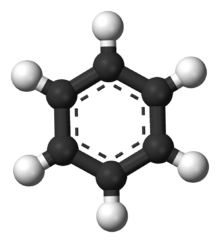
Egy benzolmolekula modellje. A szénatomok fekete színnel, a hidrogén fehér színnel van ábrázolva.
Szerkezet
A benzolnak különleges tulajdonságai vannak, amelyeket aromásságnak neveznek. A gyűrű mind a hat szénatomja ugyanabban a síkban helyezkedik el. Ahhoz, hogy a hat szénatomos gyűrű összes kötését figyelembe lehessen venni, váltakozó kettős szénkötéseknek kell lenniük (konjugált rendszer):
Ha a benzolnak három kettős kötése lenne, akkor a gyűrű három oldala rövidebb lenne, mint a másik három oldal. A röntgendiffrakció azt mutatja, hogy a benzol mind a hat szén-szén kötése azonos hosszúságú, 140 pikométer (pm). A C-C kötések hossza nagyobb, mint egy kettős kötésé (135 pm), de rövidebb, mint egy egyszerű kötésé (147 pm). Ez a köztes távolság összhangban van az elektron-delokalizációval: a C-C kötéshez szükséges elektronok egyenlően oszlanak meg a hat szénatom között. A molekula planáris. Az egyik ábrázolás szerint a szerkezet úgynevezett rezonancia szerkezetek szuperpozíciójaként létezik, nem pedig bármelyik forma külön-külön. (Más szóval, a molekula kettős kötései gyorsan váltanak a szénatom-párok között). Az elektronok delokalizációja az egyik magyarázat a benzol és a rokon aromás vegyületek termodinamikai stabilitására. Valószínű, hogy ez a stabilitás hozzájárul az aromásságnak nevezett sajátos molekuláris és kémiai tulajdonságokhoz. A kötés delokalizált jellegének jelzésére a benzolt gyakran úgy ábrázolják, hogy a szénatomok hatszögletes elrendezésében egy kör van.
A szerves kémiában szokásos módon a fenti ábrán a szénatomokat nem jelöltük. Mivel minden szénatomnak 2p elektronja van, minden szénatom egy-egy elektront ad a benzolgyűrű feletti és alatti delokalizált gyűrűbe. A p-orbitálisok átfedése a gyűrű felett és alatt egyaránt a pi-felhőket eredményezi.
1986-ban néhány kémikus a Nature folyóiratban megjelent cikkében vitatta a benzol delokalizált nézetét. Kimutatták, hogy a benzolban lévő elektronok szinte biztosan egyes szénatomokhoz lokalizálódnak. Kimutatták, hogy a benzol aromás tulajdonságai inkább a spincsatolásból, mint az elektronok delokalizációjából származnak. Más tudósok 1987-ben cikkeket írtak ezt a nézetet alátámasztandó a Nature-ben. A kémikusok azonban csak lassan váltanak át a delokalizált elektronok nézetéről.
A benzol származékai elég gyakran fordulnak elő szerves molekulák alkotórészeként ahhoz, hogy az Unicode szimbólum a Miscellaneous Technical blokkban U+232C (⌬) kóddal jelöli három kettős kötéssel, és U+23E3 (⏣) kóddal a delokalizált változatot.
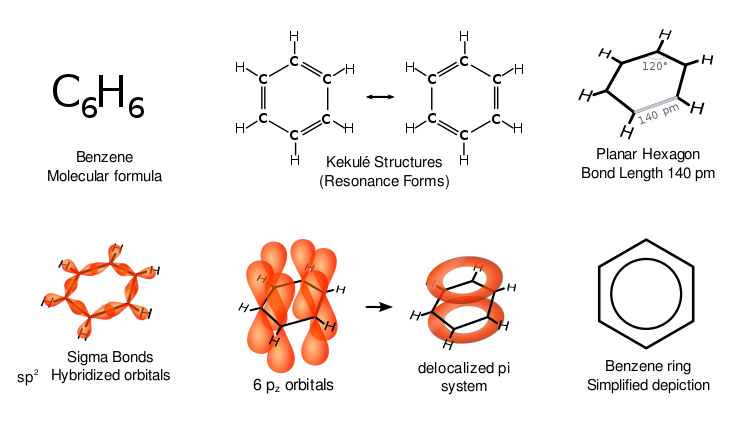
A benzol különböző ábrázolásai
Kérdések és válaszok
K: Mi az a benzol?
V: A benzol egy szerves kémiai vegyület.
K: Mi a benzol kémiai képlete?
V: A benzol kémiai képlete C6H6.
K: Milyen a benzol megjelenése és szaga?
V: A benzol színtelen és gyúlékony folyadék, amelynek édes illata van.
K: Milyen szerkezetű a benzol molekula?
V: A benzolmolekula egy hat szénatomból álló gyűrű, amelyek egy-egy hidrogénatomhoz kapcsolódnak. Ez egy aromás vegyület, ami azt jelenti, hogy a gyűrűben váltakozó kettős kötések vannak.
K: Rákkeltő-e a benzol?
V: Igen, a benzol rákkeltő, ami azt jelenti, hogy rákot okozhat.
K: Milyen gyakorlati felhasználási módjai vannak a benzolnak?
V: A benzolt adalékanyagként használják a benzinben, műanyagokban, szintetikus gumiban, színezékekben, és ipari oldószer, ami azt jelenti, hogy számos más kémiai molekulát képes feloldani. Sok gyógyszer is tartalmaz benzolból készült részeket.
K: Hol található a benzol?
V: A benzol a nyersolaj természetes része, ezért jelen van a benzinben.
Keres