Atomi pályák (orbitálok): definíció, elektronok és kvantummechanika
Atomi pályák (orbitálok) magyarázata: definíciók, elektronok viselkedése, kvantummechanika alapjai és elektronkonfigurációk egyszerű, szemléletes bemutatása.
Az atomi pályák azok az atommagot körülvevő régiók, ahol az elektronok egy adott időpontban a legnagyobb valószínűséggel tartózkodnak. Kvantummechanikai értelemben az atomi pálya egy hullámfüggvény (ψ), és az ennek négyzetének abszolútértéke, |ψ|², adja meg a helyfüggő valószínűségsűrűséget: azaz azt, hogy egy elektron bizonyos térbeli tartományban található-e. A hullámfüggvény általában komplex értékű, és matematikai megoldása a Schrödinger-egyenletből vagy annak közelítéseiből adódik.
Miben különbözik az orbitál az "elektron keringésétől"?
A korai modellekben — például a bolygómozgató Bohr-modellben — az elektronokat úgy képzelték, mintha a Naprendszerhez hasonlóan keringnének; az atommag volt a Nap, az elektronok pedig bolygók. A kvantummechanika azonban megmutatta, hogy ez a kétdimenziós, pontos pályákra bontó kép megtévesztő: az elektronoknak nincs meghatározott klasszikus pályájuk, hanem hullámtermészetük miatt valószínűségi eloszlásuk van. Az "orbitál" ezért nem egy körút, hanem egy állapot, amelyet hullámfüggvény ír le.
Kvantumszámok és az orbitálok jellemzése
Az atomelméletben és a kvantummechanikában az atomi orbitálokat egy kvantumszám. rendszerével írjuk le. A legfontosabb kvantumszámok:
- Főkvantumszám (n): meghatározza az energiahéjat és az orbitál méretét (n = 1, 2, 3, ...).
- Mellékkvantumszám (l): az impulzusmomentum nagyságához kapcsolódik, és meghatározza az orbitál alakját (s: l=0, p: l=1, d: l=2, f: l=3 stb.).
- Mágneses kvantumszám (m_l): az adott l értékhez tartozó orientációkat írja le az adott tengelyhez viszonyítva (m_l = −l...+l).
- Spinkvantumszám (m_s): az elektron belső spinjének irányát jelöli (m_s = +½ vagy −½), ez határozza meg, hogy egy orbitálban legfeljebb két elektron lehet-e kiegészítő spinnel.
Azaz egy adott orbitál teljesen leírható a kvantumszámok halmazával (n, l, m_l) és a benne lévő elektron spinjével (m_s).
Az orbitálok alakja és csomósíkok
Az egyes típúsú orbitálok jellegzetes alakokkal rendelkeznek: az s-orbitál gömbszimmetrikus, a p-orbitálok hantola alakúak és tengelyirányhoz kötöttek, a d- és f-orbitálok összetettebb, több csomósíkot tartalmazó alakzatok. Az orbitálokban megjelenő csomósíkok (nodusok) olyan felületek, ahol a hullámfüggvény zérus, tehát az elektron valószínűsége ott nulla. A csomósíkok száma összefügg a kvantumszámokkal: a főkvantumszám növelésével több radiális csomó és összetettebb alakzat jelenik meg.
Energia, foglaltság és többelektronos atomok
Egy egyszerű, hidrogénszerű rendszerben az energia jól definiált és csak a főkvantumszámtól függ. Többelektronos atomokban azonban a pályák energiája függ a kölcsönhatásoktól (elektron-elektron taszítás, pályarekonstrukció), ezért a pontos energiaszinteket csak közelítő módszerekkel lehet meghatározni (pl. Hartree–Fock, sűrűségfunkcionál-elmélet). Egy adott héjon n^2 különböző orbitál létezik, és egy orbitál maximum két, ellenkező spinű elektront foglalhat el (Pauli-elv).
Elektronkonfiguráció, szabályok és kémiai következmények
Egy atom elektronjai az orbitálok között rendeződnek be az alábbi elvek szerint: Pauli-exklúzió (minden elektronra más a négy kvantumszám), Aufbau-elv (alacsonyabb energiafelé töltődnek először), és Hund-szabály (azonos energiájú orbitálok esetén a spinek párosítása később történik). Az orbitálok betöltődése határozza meg az atom kémiai viselkedését és kötési hajlamát: azonos vagy hasonló külső elektronkonfigurációk vezetnek hasonló kémiai sajátosságokhoz.
Spektroszkópia és történeti megfigyelések
A korai spektroszkópiai megfigyelések segítettek felfedezni, hogy az atomok diszkrét energiákkal rendelkeznek: bizonyos alkálifémek spektroszkópiai vonalai élesek voltak, és különböző típusú vonalak (fővonalak, diffúzak, alapvonalak) jelentek meg. Az elektronátmenetek a pályák (állapotok) között hozzák létre az emissziós vagy abszorpciós vonalakat. A spektrumok értelmezése vezetett a kvantumszámok és az orbitalisokonceptus kidolgozásához.
Alkalmazások és továbbfejlesztések
Az atomi pályák fogalma nemcsak az elméleti atomfizikában fontos, hanem a kémiai kötések megértésében (molekulapálya-elmélet, hibridizáció), anyagtudományban (sávszélek, vezetés) és spektroszkópiában (ESR, NMR, röntgen). A modern számítógépes módszerek segítségével sokelektronos rendszereknél is meg lehet becsülni az orbitálok alakját és energiáját, illetve a könnyebben nem leírható korrelációs hatásokat is.
Összefoglalva: az atomi pályák a kvantummechanikai hullámfüggvények által leírt állapotok, amelyek meghatározzák az elektronok térbeli eloszlását, energiáját és spinjét, és központi szerepet játszanak az atom és molekula tulajdonságainak megértésében.
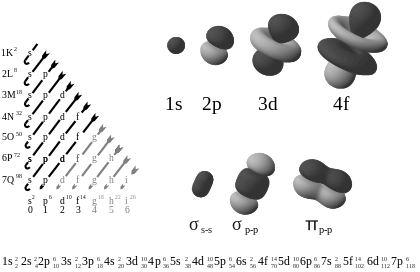
A bal oldali ábra az orbitálisokat növekvő energia sorrendben mutatja. A jobb oldalon példák láthatók az orbitális alakzatokra.
Kapcsolódó oldalak
- Elektronfelhő
- Molekuláris orbitál
Kérdések és válaszok
K: Mik azok az atomi pályák?
V: Az atomi pályák azok az atommagot körülvevő területek, ahol az elektronok a legnagyobb valószínűséggel találhatók.
K: Mi az a matematikai függvény, amely leírja az elektronok viselkedését egy atomban?
V: Az atomban lévő elektronok viselkedését leíró matematikai függvény egy hullámszerű függvény.
K: Miért használják az "orbitális" szót?
V: Az "orbitális" szót az atommagot körülvevő azon területek leírására használják, ahol az elektronok a legnagyobb valószínűséggel találhatók, mert egykor úgy hitték, hogy az elektronok úgy viselkednek, mint a Nap körül keringő bolygók.
K: Hogyan határozzák meg egy elemben az atomi pályák számát?
V: Egy elemben az atomi pályák számát az elem periódusa határozza meg.
K: Miért mozognak az elektronok a pályák között?
V: Az elektronok a pályák között a sebességüktől és a jelenlévő más elektronok számától függően mozognak.
K: Mi az atomi pálya az atomelméletben és a kvantummechanikában?
V: Az atomi pálya az atomelméletben és a kvantummechanikában egy kvantumszám.
K: Hány elektron foglalhat el egy-egy atomi orbitált?
V: Minden egyes atomi orbitálison egy vagy két elektron foglalhat helyet.
Keres