Addíciós reakciók a szerves kémiában: definíció, típusok és példák
Addíciós reakciók a szerves kémiában: részletes definíció, típusok (elektrofil, nukleofil, radikális), mechanizmusok és gyakorlati példák világos magyarázatokkal és illusztrációkkal.
A szerves kémiában addíciós reakció akkor történik, amikor két molekula összeadódik, hogy egy nagyobbat alkosson. Ez csak akkor történhet meg, ha az egyik molekulának már van kettős vagy hármas kötése. Ezek lehetnek szén-szén kötések vagy akár szén-oxigén, szén-nitrogén és egyéb kötések. A két molekula közül az egyiket nukleofilnak nevezzük, és ez az, amelyik elektronokat ad a másiknak az új kötés létrehozásához. A másik molekulát elektrofilnek nevezzük, és ez az, amelyik megkapja az elektronokat. Az addíció tipikusan csökkenti a kötésszorzót (például kettős kötésből egyszeres lesz), és gyakran exoterm folyamat.
Miért fontos az addíció?
Az addíciós reakcióok lehetővé teszik a kettős és hármas kötésekkel rendelkező vegyületek funkcióinak bővítését és a molekulák gyors felépítését, ezért központi szerepük van a szerves szintézisben. Gyakran használják őket finomkémiai és gyógyszeripari előállításokban, valamint polimerizációs folyamatokban (pl. etén addíciója vezet polietilénhez).
Típusok és jellemzőik
- Elektrofil addíció – egy elektrofil aktiválja a kettős kötést, majd a keletkező karbokationt nukleofil támadja. Tipikus példák: halogénekkel történő addíció, savkatalizált hidratáció. Itt fontos a Markovnyikov-szabály (a proton a kevésbé helyezett szénre adódik), hacsak nem szerepel speciális reagens (pl. hidroborálás).
- Nukleofil addíció – főként polarizált kettős kötésekre, például karbonilon történik. A nukleofil hozzáadódik a karbonilhoz, majd protonálódással alkohol vagy azon származék jön létre (pl. Grignard-reakciók, cianoaddíciók).
- Radikális addíció – gyökös mechanizmussal megy végbe, gyakori iniciátorokkal (fény, peroxidok). Példa: HBr addíció peroxiddal, illetve bizonyos polimerizációk.
- Cikloadíciók – két többszörös kötés között egyszerre több kötés alakul; tipikus a Diels–Alder-reakció (conjugált dien + alkén → ciklohexén-származék).
- Koncert mechanizmusú addíciók – az összes kötésképződés egyszerre történik (például bizonyos periciklik reakciók), szemben a lépésenkénti mechanizmusokkal.
Mechanizmusok és szelektivitás
Az addíciós reakcióknál fontos fogalmak:
- Regioszelektivitás – melyik szén atom kapja a bejövő részt (például Markovnyikov vs. anti‑Markovnyikov viselkedés). A reagens és a körülmények (pl. peroxidok, katalizátorok) befolyásolják.
- Stereoszelektivitás – a beéptődő csoportok relatív térbeli elhelyezkedése: syn (azonos oldalon) vagy anti (ellentétes oldalról) addíció. Példa: hidrogénezés általában syn addíciót ad; halogén-addíciók anti jelleget mutatnak a közbenső haloniumion miatt.
- Reverzibilitás – az addíció gyakran egyensúlyi folyamat; az ellenkező irány az eliminációs reakció, amely visszaállíthatja a többszörös kötést.
Gyakori példák
- Hidrogénezés – H2 addíció katalizátor (Pt, Pd, Ni) jelenlétében: alkénekből alkánok. Fontos ipari folyamat a telítetlen zsírok keményítésénél és a finomkémiai redukcióknál.
- Halogénezés – X2 (Cl2, Br2) addíció alkénekhez → dihalogénezett termékek; általában anti addíciót ad.
- Hidrohalogenálás – HBr, HCl addíció alkénekre; gyakran Markovnyikov-szabályt követi, kivétel peroxid jelenlétében (peroxid-indukált anti‑Markovnyikov HBr-addíció).
- Hidratáció – víz addíciója savkatalízissel alkénekhez → alkoholok; alternatív módszer: hidroborálás-oxidáció (anti‑Markovnyikov, syn sztereokémia).
- Karbonilok nukleofil addíciója – például Grignard-reakció: RMgX reagál a karbonillal, majd protonálással alkohol keletkezik; cianoaddícióval ciano-hidrin, aminoképződéssel iminek/oximek alakulhatnak.
- Epoxidálás és gyűrűnyitás – alkének epoxiddá oxidálása, majd nukleofil gyűrűnyitás; például peroxidokkal vagy mCPBA-val való epoxidálás.
Katalizátorok, körülmények és gyakorlati megfontolások
A reakcióútvonalat és a termékösszetételt befolyásolja: oldószer, hőmérséklet, savas vagy bázisos katalizátorok, jelenlévő iniciátorok (fény, peroxidok) és a reaktánsok elektronikus/térbeli tulajdonságai. Bizonyos addíciók (pl. hidroborálás) szelektívebbek és kisebb mellékterméket adnak, míg mások gyors, de kevésbé szelektív transzformációk.
Összegzés
Az addíciós reakciók alapvető eszközök a szerves szintézisben: lehetővé teszik kettős vagy hármas kötések funkcionálásának bővítését és új C–X kötések (X = H, halogén, OH, OR, stb.) kialakítását. Mechanisztikájuk, szelektivitásuk és alkalmazhatóságuk sokféle módszert és reagenseket igényel, így a reakciók megtervezésekor mindig figyelembe kell venni a kívánt regiokémiát és stereokémiát, valamint a biztonsági és ipari szempontokat.
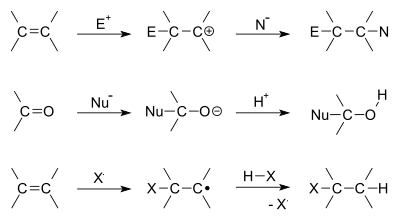
Néhány példa az addíciós reakciókra
Kérdések és válaszok
K: Mi az addíciós reakció a szerves kémiában?
V: Addíciós reakciónak nevezzük, amikor két molekula egy nagyobb molekulát alkotva egyesül, és csak akkor következhet be, ha az egyik molekula kettős vagy hármas kötéssel rendelkezik.
K: Milyen típusú kötéseknél fordulhat elő addíciós reakció?
V: Szén-szén kötések, szén-oxigén kötések, szén-nitrogén kötések és egyéb kötések mind lehetnek addíciós reakciók.
K: Mi a nukleofil egy addíciós reakcióban?
V: A nukleofil az a molekula, amely az új kötés kialakításához elektronokat ad a másik molekulának.
K: Mi az elektrofil egy addíciós reakcióban?
V: Az elektrofil az a molekula, amely az új kötés kialakításához elektronokat vesz fel.
K: Miben különbözik az addíciós reakció az eliminációs reakciótól?
V: Az addíciós reakcióban két molekula egyesül, hogy egy nagyobb molekulát alkosson, míg az eliminációs reakcióban egy nagyobb molekula két kisebbre bomlik.
K: Mi a példa az addíciós reakcióra?
V: A víz addíciója kettős kötésen keresztül és a karbonil nukleofil támadása gyakori példái az addíciós reakcióknak.
K: Történhetnek-e addíciós reakciók kettős vagy hármas kötés nélkül?
V: Nem, az addíciós reakciókhoz kettős vagy hármas kötés szükséges legalább az egyik molekulában.
Keres