Karbonil (C=O): definíció, szerkezet, reakciók és azonosítás
Karbonil (C=O): tömör útmutató szerkezetéről, reakcióiról (nukleofil addíciók, redox) és azonosításáról (IR, 13C‑NMR), példákkal és gyakorlati alkalmazásokkal.
A karbonil a molekulában található C=O csoport, amely egy szén- és egy oxigénatom között meglévő kettős kötés van. A karbonil-szénnek általában további két σ-kötése van, amelyek különböző oldalláncokhoz (R-csoportokhoz) kapcsolódhatnak; ilyen fontos típusai a keton, az aldehid és az észter.
Szerkezet és elektroneloszlás
A karbonilcsoportban a szén és az oxigén sp2 hibridizált, a három hibridizált pálya trigonal planáris geometriát ad (körülbelül 120°-os kötésszögek), míg a π-kötés a nemhibridizált p-pályák átfedéséből jön létre. Mivel az elektronegatívabb oxigén az elektronokat erősebben vonzza, az elektronok a kötésben inkább az oxigén felé tolódnak, így a szén részlegesen pozitív töltésű lesz. Ez a polaritás magyarázza a karbonil reakciókban mutatott elektrofíliaját: a nukleofilok a szénatom felé támadnak.
Resonancia és reaktivitás
A karbonilcsoportot két juharresonancia-forma írja le: a stabilabb formában a kettős kötés C=O, egy alternatív, kevésbé stabil rezonanciaforma szerint az oxigén negatív töltést, a szén pedig pozitív töltést visel (O-–C+). Ez a rezonanciaalapú töltéseloszlás növeli a szén elektrofíliai jellegét.
Fontos reakciótípusok
- Nukleofil addíció (aldehidek és ketonok esetén): nukleofilok (pl. hidrid, alkoxidok, CN-, aminek hatására alkoholok, cyanohidrinek, hemiacetálok/acetálok, iminok keletkezhetnek).
- Nukleofil acilcserék (észterek, savkloridok, amidok esetén): a karbonilhoz kötődő csoport lecserélődik (pl. amináció, alkoholízis), mert a karbonil karbonja elektrofíl.
- Redukció: aldehidek/ketonok redukálhatók alkoholokká LiAlH4 vagy NaBH4 segítségével; aldehidek könnyen oxidálhatók karbonsavakká.
- Enolizáció és enolátképződés: alfa-hidrogének savas vagy bázisos feltételek mellett protonátadással eltávolíthatók, enol ill. enolát képződik, ami alfa-alkilezések, aldol-kondenzációk és más szubsztitúciós reakciók kiindulópontja.
- Kondenzációs reakciók: aldol-kondenzáció, Claisen-kondenzáció és más C–C kötésépítő reakciók a karbonilok enolát intermedierjét használják fel.
- Wittig-reakció: karbonilból alként lehet előállítani foszfonium ylide-ok használatával.
- Grignard-reakciók: Grignard-reagenssel történő addíció után gyakran tercier alkoholok képződnek.
Katalízis és környezeti hatások
A karbonil-reakciók gyakran sav- vagy báziskatalizáltak. Sav jelenlétében a karbonil oxigén protonálódhat (savban), ami még inkább növeli a karbonilkarbon elektrofilitását, ezért a proton az oxigénatomra kerülve gyorsíthatja a nukleofil addíciókat. Konjugáció (például aromás gyűrűkkel vagy C=C kapcsolattal) csökkentheti a C=O nyújtott kettősségét és ennek megfelelően változtatja a reaktivitást.
Spektroszkópiai azonosítás
- Infravörös (IR): a karbonil jellegzetes, erős C=O nyúlási sávot ad, tipikusan ~1600–1800 cm-1 tartományban; pontos helyzet függ a funkciós csoporttól (pl. észterek általában ~1735–1750 cm-1, ketonok ~1705–1725 cm-1, amidok gyakran az alacsonyabb tartományokban), valamint a konjugáció és a hidrogénkötés befolyásolja az értéket. Éppen ezért az infravörös spektroszkópiában a karbonil általában nagyon erős jelet ad.
- 13C NMR: a karbonil-szén jele nagyon lecsúszott (alacsony térfrekvenciától eltérően magas kémiai eltolódás): tipikusan ~160–220 ppm között jelenik meg, a pontos tartomány függ a karbonil típusától (észterek, amidok, savak észterei, ketonok, aldehidek). Ennek megfelelően a szén-NMR-spektroszkópiában a jel általában nagyon magas frekvencián, sok más csúcstól távol van.
- 1H NMR: aldehidek esetén jellegzetes aldehidproton figyelhető meg ~9–10 ppm körül; más protonok (pl. alfa-protonok) a karbonil közelsége miatt ledeszieldődnek.
- UV–Vis: konjugált karboniloknál elektronátmenetek következtében jellemző eltolódások lépnek fel, amelyek diagnosztikusak lehetnek.
- Tömegspektrometria: bizonyos fragmensek és hasítási mintázatok is segíthetnek a karboniltartalom igazolásában.
Előfordulás és jelentőség
A karbonilcsoport rendkívül gyakori a természetben és az iparban: jelen van számos biomolekulában (például peptidekben található amidok karboniljai), természetes termékekben, gyógyszerekben és más aktív összetevőkben. A karbonilok reaktivitása és sokféle átalakíthatósága miatt kulcsszerepet játszanak a szerves szintézisben és a gyógyszerkémiai tervezésben.
Gyakorlati megjegyzések
- A karbonilok reakciói gyakran szelektivitási kérdéseket vetnek fel (pl. melyik karbonilt támadja a nukleofil, ha többszörös van jelen), ezért a reakciófeltételek és katalizátorok gondos megválasztása szükséges.
- A hidrogénkötés és konjugáció jelentősen befolyásolja mind az IR frekvenciákat, mind a kémiai eltolódásokat, továbbá a reakciók kinetikáját és termodinamikáját is.
Összefoglalva: a karbonil (C=O) egy jól definiált, sp2 hibridizált, polarizált funkciós csoport, amelynek kémiai viselkedését a szén részleges pozitív töltése és az oxigén részleges negatív töltése határozza meg. Emiatt a karbonilok könnyen vesznek részt nukleofil addíciós és acilcserés reakciókban, valamint számos szintetikus és biológiai folyamatban kulcsfontosságúak.
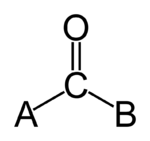
Karbonilcsoport
Kérdések és válaszok
K: Mi az a karbonil?
V: A karbonil egy molekulában lévő olyan csoport, amely egy szén- és egy oxigénatomból áll, amelyek között kettős kötés van.
K: Mi az a két másik kötés, amelyet a szén egy karbonilban kialakíthat?
V: Egy karbonilban a szén két másik kötést is kialakíthat, amelyek bármely más csoporttal lehetnek.
K: A karbonilban melyik atom vonzza a savban lévő protont?
V: Savban a karbonilban lévő oxigénatom vonz egy protont.
K: Hogyan hibridizálódik a szén és az oxigén a karbonilcsoportban?
V: A karbonilcsoportban mind a szén-, mind az oxigénatomok sp2-hibridizáltak.
K: Miért fontos funkciós csoport a karbonilcsoport a kémiában?
V: A karbonilcsoport azért fontos funkciós csoport a kémiában, mert a kémikusok számos reakciót végezhetnek vele, beleértve mind a nukleofil addíciókat a molekula nagyobbá tételéhez, mind a redoxireakciókat alkohol képződéséhez.
K: Hol találhatók karbonilcsoportok?
V: Karbonilok számos természetes anyagban, drogban és gyógyszerben megtalálhatók.
K: Hogyan lehet könnyen ellenőrizni, hogy egy molekula tartalmaz-e karbonilt?
V: Egyszerűen ellenőrizhetjük, hogy egy molekula tartalmaz-e karbonilt, infravörös spektroszkópiával, amely erős jelet ad, vagy szén-NMR-spektroszkópiával, amelyben a jel általában nagyon magas frekvencián van, távol sok más csúcstól.
Keres