Keratin (szaru): rostos fehérje — szőr, szarv, köröm, toll
Keratin (szaru): rostos fehérje, amely alkotja a szőrt, szarvakat, körmöket és tollakat — kemény, oldhatatlan váz az állatoknál. Ismerd meg szerkezetét és biológiai szerepét.
A keratinok a rostos fehérjék családjába tartoznak. A keratin alkotja az állatok szőrét, valamint a szarvakat, körmöket, patákat, csőröket és tollakat. A név a görög kerasz szóból származik, amely szarvat jelent. Fontos megjegyezni, hogy a keratin nem képezi a kalcium-karbonátból álló héjszerkezeteket; tehát nem ugyanazokból az anyagokból épülnek fel például a tengeri kagylókat alkotó héjak.
Szerkezet és típusok
A keratinok többféle formában fordulnak elő, alapvetően két csoportot különböztetünk meg:
- Alfa-keratin – főként emlősökben található (pl. haj, bőr, köröm). Az alfa-helikális szerkezetű polipeptid-láncok középfibrillumokat (intermediate filaments) alkotnak, amelyek erős, rugalmas rostokat hoznak létre.
- Beta-keratin (korábbi nevén corneous beta-proteins) – jellemző a madarakra és hüllőkre; beta-hajtűszerkezetű szekvenciákból áll, és különösen merev, kemény struktúrákat ad (pl. tollak, pikkelyek, csőrök).
A keratinok gazdagok kéntartalmú aminosavakban (különösen cisztein), amelyek diszulfidkötéseket képezve további keresztkötéseket adnak a rostok között — ez magyarázza a kemény keratinok (köröm, szarv) nagy mechanikai szilárdságát. A puhább keratinokban kevesebb a cisztein, ezért rugalmasabbak.
Biológiai szerep
A keratin elsődleges funkciója a mechanikai védelem és a vízveszteség csökkentése. A bőr külső rétegét képező keratinizált sejtek (keratinocyták) vízálló, kopásálló burkot hoznak létre, amely véd a fizikai behatásoktól, patogénektől és kiszáradástól. A keratin alkotja a szőrzetet, a tollakat és a különféle járulékos képleteket, amelyek szerepet játszanak hőszabályozásban, védekezésben, táplálékszerzésben és párzási jelzésekben.
Előfordulás és bioszintézis
A keratin alapvetően gerinces állatokra jellemző. A keratinfehérjéket specifikus KRT géncsalád kódolja; a sejtekben a szintézis után a keratinfilamentumok összeállnak és fokozatosan keratinizálódnak, amíg a sejt el nem hal (pl. a haj és a köröm formálódása során). A keratin jellemzően oldhatatlan és nehezen lebomló a hagyományos proteázok számára, ezért nagy a biológiai tartóssága.
Klinikai és alkalmazott szempontok
- Orvosi jelentőség: A keratin szerkezetét kódoló gének mutációi bőr- és körömbetegségekhez vezethetnek (például különböző öröklődő keratinopathiák, bőrrepedezést okozó betegségek). A bőr integritásának zavara fokozott sérülékenységet eredményezhet.
- Kozmetika és hajápolás: A keratin-készítmények és „keratin-kezelések” a haj kisimítására és fényesítésére irányulnak; ezek többsége részben filmképző anyagokat, illetve keratin-hidrolizátumokat használ.
- Ipari felhasználás: A baromfihulladékból (tollak, csőrmaradványok) és más keratinhulladékból kinyert keratint komposztálásra, takarmányadalékként, műtrágya- vagy biomateriálként dolgozzák fel. Léteznek kifejezetten keratinbontó enzimek (keratinázok), amelyeket mikrobák termelnek és ipari hasznosításra is fejlesztenek.
Lebomlás és környezeti aspektusok
Mivel a keratin ellenáll a hagyományos lebontásnak, a természetben speciális mikroorganizmusokra (baktériumok, gombák) van szükség a degradációhoz. Az ilyen mikroorganizmusok által termelt keratinázok fontos szerepet játszanak az ökológiai körforgásban, és a kutatás célja gyakran a keratinhulladékok hatékony, környezetbarát újrahasznosítása.
A keratinok tehát különböző formákban és szerepekben jelennek meg az állati testfelépítésben: védelmet, mechanikai támogatást és funkcionális előnyöket biztosítanak, miközben biokémiai és ipari szempontból is jelentősek. Hasonló biológiai szívósságot mutat a kitin is, bár a két anyag kémiai felépítése és előfordulása különbözik.
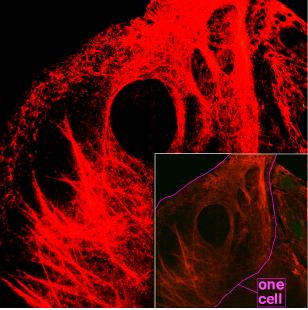
Keratinszálak mikroszkópos vizsgálata a sejtek belsejében.
Különféle állati felhasználási módok
A keratinok a bőrből kinövő struktúrák fő alkotóelemei:
- az emlősök szőrében (beleértve a gyapjút is), szarvában, körmében, karmaiban és patáiban található α-keratinok.
- a keményebb β-keratinok a hüllők pikkelyeiben és karmaiban, páncéljukban (chelonia, pl. teknős, teknős, teknősbéka), valamint a madarak tollában, csőrében és karmaiban. Ezek a keratinok főként béta lapokban képződnek. Béta-lapok azonban α-keratinokban is előfordulnak.
Az ízeltlábúak, például a rákfélék külső vázának egyes részei gyakran keratinból, néha kitinnel kombinálva készülnek.
Keratinok számos állat, köztük a kerekesférgek (amelyek külső rétege szintén keratinból áll) gyomor-bélrendszerében is megtalálhatók.
Bár ma már nehéz biztosra menni, a dinoszauruszok pikkelyei, karmai, egyes védőpáncéljai és csőre szinte biztosan valamilyen keratinból álltak.
Silk
A rovarok és pókok által termelt selyemfibroint gyakran a keratinok közé sorolják, bár nem világos, hogy filogenetikai rokonságban állnak-e a gerincesek keratinjaival.
A rovarbábokban, pókhálóban és tojáshüvelyekben található selyem szintén csavart β-bolyhos lapokat tartalmaz, amelyek nagyobb szupermolekuláris aggregátumokba tekeredett szálakba vannak beépítve.
Keres