Tiálok (tioaldehidek): definíció, szerkezet és reaktivitás
Tiálok (tioaldehidek) áttekintése: definíció, kémiai szerkezet, reaktivitás és szintézis kihívásai. Gyors Diels–Alder reakciók, stabilizálás és alkalmazások.
A tiál vagy tioaldehid bármely molekula, amelynek RC(S)H csoportja van. Olyan, mint egy aldehid, amelynek oxigénatomját kénre cserélték. A kén kettős kötéssel kapcsolódik a szénhez. Két magányos párt is megtart.
A tiálok általában nagyon reaktívak, mert nagyon jó elektrofilek. Nehéz őket előállítani, mert amint kialakulnak, önmagukkal is reakcióba lépnek: könnyen oligomerizálódnak vagy adductumokat képeznek. Nagyon gyorsan képesek Diels-Alder reakciókat végrehajtani, ezért gyakran in situ állítják elő és azonnal felhasználják. Ha azonban terjedelmes R-csoportokat használnak, a tiál stabilabb lehet, így izolálhatóbbá válik.
Ha a H-csoportot egy másik R-csoportra cseréljük, akkor a molekulát tioketonnak nevezzük. Ezek általában stabilabbak, mint a megfelelő tiálok.
Strukturális és elektronikus jellemzők
A tiálokban a C=S kötés geometriája hasonló az aldehidek C=O csoportjához, de a kén nagyobb atomsugara és polarizálhatósága miatt a kötés elektroneloszlása és reaktivitása eltér. A kén kevésbé elektronegativ, ezért a C–S kémiában a szén részben pozitívabb töltésviszonyt vehet fel, ami növeli a nukleofil támadásokra való hajlamot. Emellett a kén jobb térkitöltő képessége és nagyobb polarizálhatósága elősegíti a pericitikus és koordinációs reakciókat.
Szintézis
A tiálokat leggyakrabban aldehidekből állítják elő thionálással, amikor az oxigént kénre cserélik. Gyakori thionálószerek például a Lawesson-reagens és a foszfor-pentaszulfid (P4S10). Sok esetben a tiálokat alacsony hőmérsékleten és inert atmoszférában állítják elő, és közvetlenül a következő reakciólépésben használják fel, mivel izolálva hajlamosak a bomlásra és polimerizációra.
Fizikai és spektrális tulajdonságok
A tiálok spektrális jelei eltérnek az oxigén-tartalmú analógoktól. IR-spektrumukban a C=S nyúlás általában más frekvencián jelenik meg, mint a C=O jel, és a nagyobb polarizálhatóság miatt a elektronátmenetek (UV–Vis) is eltérhetnek; sok thiokarbonyl-vegyület élénkebb színt mutat. Több tioketon és típusú thiocarbonyl-származék intenzív színnel rendelkezik, ami a π→π* és n→π* átmenetek sajátosságaival van összefüggésben.
Reaktivitás és tipikus átalakulások
- Nukleofil addíció: a C=S szénatomjára nukleofil támadás történhet, hasonlóan a karbonilokhoz, de gyakran gyorsabban.
- Cikloadíciók: a tiálok jó dienofílként viselkednek, ezért például Diels-Alder típusú reakciókban nagyon reaktívek.
- Oligomerizáció/polimerizáció: sok egyszerű tiál hajlamos önreakcióra, dimerizálódásra vagy polimerizálódásra, ezért izolálásuk nehéz lehet.
- Átalakulás tioketonná: ha a formil-hidrogént helyettesítik egy szerves csoporttal, kialakul a relatíve stabilabb tioketon.
Gyakorlati szempontok és alkalmazások
Az erősen reaktív természet miatt a tiálokat gyakran csak mint reakcióintermediereket használják. Alkalmazzák őket szerves szintézisben, például heterociklusok előállításában, illetve olyan reagensekként, amelyek speciális C–S kötésbeavatkozásokat tesznek lehetővé. Sok tiál kellemetlen szagú és érzékeny a levegőre vagy nedvességre, ezért elővigyázatos kezelés, alacsony hőmérséklet és inert gázok alkalmazása ajánlott.
Összefoglalás
A tiálok (tioaldehidek) a karbonilszármazékok kéntartalmú párjai: RC(S)H csoportjuk miatt funkcionálisan az aldehidekhez hasonlóak, de elektronikus és sterikai különbségek miatt gyakran jóval reaktívabbak. Stabilizálásukhoz nagy, terjedelmes R-csoportokra vagy speciális körülményekre van szükség; ha a H helyére R kerül, a rendszer tioketonná alakul, ami általában kevésbé reakcióképes.
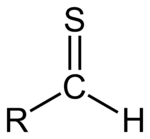
A thial általános szerkezete
Keres