Atomelmélet: történet, szerkezet és szubatomi részecskék
Atomelmélet: történet, szerkezet és szubatomi részecskék — Démokritosztól a modern kvarkokig; protonok, neutronok, elektronok, mag és alkalmazások áttekintése.
A kémiában és a fizikában az atomelmélet magyarázza, hogyan változott az atomról alkotott képünk az idők során. Az atomokat egykor az anyag legkisebb darabjainak tartották. Ma már azonban tudjuk, hogy az atomok protonokból, neutronokból és elektronokból állnak. Ezek a szubatomi részecskék kvarkokból állnak. Az atomra vonatkozó első elképzelés a görög filozófustól, Démokritosztól származik. A modern elmélet sok ötlete John Daltontól, egy brit kémikustól és fizikustól származik.
Az elmélet szilárd, folyékony és gáz halmazállapotú anyagokra alkalmazható, de a plazmákra és a neutroncsillagokra nem alkalmazható analóg módon.
Történeti áttekintés
Az atom fogalma hosszú fejlődés eredménye. A görög gondolkodók (például Démokritosz) már az ókorban feltételeztek megoszthatatlan részecskéket, de a tudományos bizonyítékok csak a 19–20. század fordulóján jelentek meg. John Dalton a kémiai reakciók és arányok alapján visszaállította az atomok jelentőségét a kémiai elméletben. A kísérleti bizonyítékok — például a katódsugár-kísérletek — vezettek az elektron felfedezéséhez (J. J. Thomson, 1897), majd a mag szerkezetének feltárásához (Ernest Rutherford aranyfólia-kísérlete, 1909). A neutront James Chadwick fedezte fel 1932-ben.
Az atom szerkezete röviden
- Atommag: A magban találhatók a protonok és neutronok. A protonok száma határozza meg az elem rendszámát, a neutronok és protonok együttese adja az atom tömegét (tömegszám).
- Elektronfelhő: Az elektronok a mag körül, változó tartózkodási valószínűséggel helyezkednek el; a kvantummechanika szerint pályák helyett elektronpályákhoz (orbitálokhoz) és kvantumszámokhoz kötött eloszlást használunk.
- Izotópok: Ugyanannak az elemnek különböző neutronszámú változatai léteznek — ezek az izotópok, amelyek kémiai tulajdonságaikban hasonlóak, de tömegük és nukleáris tulajdonságaik eltérhetnek.
Szubatomi részecskék és kvarkok
A protonok és neutronok nem elemi részecskék: belső szerkezetük kvarkokra vezethető vissza. A proton két "up" és egy "down" kvarkból, a neutron egy "up" és két "down" kvarkból áll. Ezeket a kvarkokat a gluonok kötik össze a kvantum-színdinamika (QCD) elmélete szerint. Az elektron viszont elemi részecske, lepton, amelynek nem ismert belső szerkezete.
Az atommodellek fejlődése
- Dalton-modell: Az atom kémiai részecskeként jelent meg, meghatározott tömegekkel és arányokkal.
- Thomson-modell: "Mazsolás pogácsa" kép, ahol az elektronok elszórtan helyezkednek el pozitív közegben.
- Rutherford-modell: A kísérletek alapján kis, sűrű, töltött mag és körülötte keringenek az elektronok.
- Bohr-modell: Állítható pályák és kvantált energiaszintek bevezetése a hidrogénspektrum magyarázatára.
- Modern kvantummechanikai modell: Schrödinger és Heisenberg munkái után az elektronok eloszlását hullámfüggvényekkel írjuk le, amely pályák helyett valószínűségi felhőt ad meg.
Kémiai és fizikai következmények
Az atomok elektroneloszlása határozza meg az anyag kémiai viselkedését: a vegyértékelektronok határozzák meg a kötéseket és a reakcióképességet. Az atomok ionizálhatók (elektron leadásával vagy felvételével), így ionok keletkeznek. Az elemek rendszere — a periódusos rendszer — az elektronkonfigurációk és a rendszám alapján rendezett, ezért előre jelezhetők a kémiai tulajdonságok.
Energia és kötés
Az atommagban lévő nukleáris kötések energiái sokkal nagyobbak, mint a kémiai kötések energiái. A nukleáris reakciók (hasadás, fúzió) jelentős mennyiségű energiát szabadítanak fel a tömeg és energia viszonyát leíró E=mc² alapján. A kötési energia, azaz az atommag tömegdefektusa, fontos fogalom a nukleáris fizikában.
Megfigyelési módszerek és bizonyítékok
- Spektroszkópia: az atomok sugárzása és elnyelése diszkrét vonalakat ad, amelyeket kvantumelmélettel lehet magyarázni.
- Szórás- és részecskegyorsító-kísérletek: ezekkel feltárhatók a mag és a kvarkok szerkezeti részletei.
- Radioaktivitás és nukleáris kísérletek: információt adnak a magok stabilitásáról és bomlási folyamatairól.
Korlátok és különleges állapotok
A cikk elején említett megjegyzés arra utal, hogy az atomelmélet hagyományos formájában nehezen alkalmazható olyan szélsőséges körülményekre, mint a plazma vagy a neutroncsillagok anyaga. Ennek oka:
- Plazma: Itt az atomok jelentős része ionizált állapotban van, az elektronok és ionok kollektiv módon viselkednek, tehát plasmaphysikára és elektromágneses kölcsönhatások kollektív leírására van szükség.
- Neutroncsillagok: Rendkívül nagy nyomáson az anyag degnerált, a protonok és elektronok összepréselődhetnek neutronokká, illetve nukleonális és kvantumdegenerált anyagok jönnek létre. Itt a nukleáris fizika és általános relativitás együttes alkalmazása szükséges; az egyszerű atomos kép nem elegendő.
Összefoglalás
Az atomelmélet folyamatosan fejlődött a filozófiai feltételezésektől a modern kvantum- és részecskefizikáig. Ma már részletes képpel rendelkezünk az atomok és szubatomi részecskék szerkezetéről, miközben tudjuk, hogy bizonyos körülmények között — például erősen ionizált plazmákban vagy ultra-sűrű csillagok belsejében — további, speciális elméletekre van szükség a pontos leíráshoz.

Démokritosz görög filozófus volt, Kr. e. 460

Roger Joseph Boscovich. Horvát jezsuita, aki az atomelmélet prototípusát adta.

John Dalton (1766-1844), angol kémikus és fizikus.
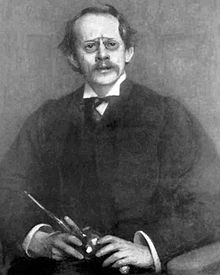
Sir Joseph John Thomson (1856-1940) angol fizikus felfedezte az elektront és annak negatív töltését. Fizikai Nobel-díjat kapott
Démokritosz atomelmélete
Démokritosz úgy gondolta, hogy ha valamit újra és újra kettévágunk, akkor végül abba kell hagynunk. Azt mondta, hogy ezt az utolsó anyagdarabot már nem lehet kisebbre vágni. Démokritosz ezeket a kis anyagdarabokat atomoknak nevezte, ami annyit jelent, hogy "oszthatatlan". Úgy gondolta, hogy az atomok örökké tartanak, soha nem változnak, és nem lehet őket elpusztítani. Démokritosz úgy gondolta, hogy az atomok között nincs semmi, és hogy minden körülöttünk lévő dolog megmagyarázható, ha megértjük az atomok működését.
Néhány más filozófus egyetértett, mások pedig nem értettek egyet. Nem volt módjuk arra, hogy kísérletekkel bizonyítsák, igaz-e az elmélete vagy sem.
Boscovich atomelmélete
1758-ban Roger Joseph Boscovich leírta az atomelmélet előfutárát.
Dalton atomelmélete
1803-ban a cumberlandi születésű angol tudós, John Dalton a következőképpen dolgozta át Démokritosz elméletét:
- Minden anyag atomokból áll.
- Az atomok oszthatatlan és láthatatlan részecskék.
- Az azonos elem atomjai azonos típusúak és tömegűek.
- A kémiai vegyületeket alkotó atomok meghatározott arányban vannak jelen.
- A kémiai változások a kémiai reakcióban részt vevő atomok átrendeződésének felelnek meg.
Dalton az atomot egy elem alapegységeként határozta meg, amely képes részt venni egy kémiai kombinációban.
Thomson atommodellje
1850-ben Sir William Crookes megépített egy "kisülési csövet", azaz egy üvegcsövet, amelyből eltávolították a levegőt, és amelynek végein fémelektródákat helyeztek el, amelyeket magas feszültségforráshoz csatlakoztattak. Ha vákuumot hozunk létre a csőben, fénykisülés látható, amely a katódtól (negatív töltésű elektróda) az anódig (pozitív töltésű elektróda) tart. Crookes a kibocsátást "katódsugárzásnak" nevezte el.
A katódsugár-kísérletek után Sir Joseph John Thomson megállapította, hogy a kibocsátott sugarat negatív töltések alkotják, mivel a pozitív pólus vonzza őket. Thomson tudta, hogy az atomok elektromosan semlegesek, de megállapította, hogy ehhez egy atomnak ugyanannyi negatív és pozitív töltéssel kell rendelkeznie. A negatív töltéseket elektronoknak (e-) nevezte el.
Az atomok semleges töltéséről felállított feltételezések alapján Thomson javasolta az első atommodellt, amelyet pozitív töltésű gömbként írt le, amelyben az elektronok (negatív töltéssel) helyezkednek el. Ez a szilvapudingmodell néven ismert.
1906-ban Robert Millikan megállapította, hogy az elektronok Coulomb (C) töltése -1,6 * 10−19, ami lehetővé tette a tömegének kiszámítását, amely 9,109 * 10−31 kg-nak felel meg.
Ugyanebben az időben Eugene Goldstein 1886-ban katódkisüléses csövekkel végzett kísérletei lehetővé tették számára, hogy megállapítsa, hogy a pozitív töltések tömege 1,6726 * 10−27 kg és elektromos töltése +1,6 * 10 C−19. Lord Ernest Rutherford később ezeket a pozitív töltésű részecskéket protonoknak nevezte el.

A Thomson-modell sematikus ábrázolása.
Rutherford atommodellje
1910-ben Ernest Rutherford új-zélandi fizikus felvetette, hogy az atom pozitív töltései főként az atom középpontjában, az atommagban találhatók, az elektronok (e-) pedig körülötte.
Rutherford ezt akkor mutatta ki, amikor egy alfa-sugárzási forrást (héliumból) használt, hogy nagyon vékony aranylemezeket találjon el, amelyeket egy cink-szulfid lámpabúra vett körül, amely látható fényt termelt, amikor az alfa-sugárzás eltalálta. Ezt a kísérletet Geiger-Marsden-kísérletnek vagy aranyfólia-kísérletnek nevezték.
Ekkorra már világosak voltak az atom fő elemei, valamint az a felfedezés, hogy egy elem atomjai izotópokban is előfordulhatnak. Az izotópok az atommagban lévő neutronok számában különböznek. Bár ez a modell jól érthető volt, a modern fizika tovább fejlődött, és a mai elképzeléseket nem lehet könnyen érthetővé tenni. A mai atomfizikáról némi elképzelés az alábbi táblázatban található linkeken található.
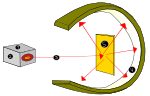
Lord Ernest Rutherford atomi kísérlete
Modern fizika
Az atomok nem elemi részecskék, mert olyan szubatomi részecskékből állnak, mint a protonok és neutronok. A protonok és neutronok azért sem elemi részecskék, mert még kisebb részecskékből, úgynevezett kvarkokból állnak, amelyeket más részecskék, úgynevezett gluonok kötnek össze (mert ezek "ragasztják" össze a kvarkokat az atomban). A kvarkok azért elemi részecskék, mert a kvarkokat nem lehet tovább bontani.
Kérdések és válaszok
K: Mi az az atomelmélet?
V: Az atomelmélet megmagyarázza, hogyan változott az atomról alkotott képünk az idők során.
K: Mit gondoltak egykor az atomokról?
V: Az atomokat egykor az anyag legkisebb darabjainak gondolták.
K: Miből állnak valójában az atomok?
V: Az atomok protonokból, neutronokból és elektronokból állnak.
K: Miből állnak a szubatomi részecskék?
V: A szubatomi részecskék kvarkokból állnak.
K: Ki volt az a görög filozófus, aki először találta ki az atom fogalmát?
V: Az atom első ötlete Démokritosz görög filozófustól származik.
K: Ki az a brit kémikus és fizikus, aki számos ötlettel járult hozzá a modern elmélethez?
V: John Dalton brit kémikus és fizikus, aki számos ötlettel járult hozzá a modern elmélethez.
K: Az atomelmélet vonatkozik a plazmákra vagy a neutroncsillagokra?
V: Az elmélet szilárd testekre, folyadékokra és gázokra is vonatkozik, de a plazmákra vagy neutroncsillagokra nem alkalmazható analóg módon.
Keres