Izotópok — mi az? Definíció, tömegszám, típusok és kémiai hatások
Izotópok — mi az? Ismerd meg definíciójukat, tömegszámukat, típusait és kémiai hatásaikat: hogyan befolyásolja a neutronok száma a reakciók sebességét és az anyag tulajdonságait.
Egy kémiai elem atomjai különböző típusokban létezhetnek — ezeket nevezzük izotópoknak. Az izotópok ugyanannyi proton (és elektron) tartalmaznak, de eltérő számú neutron van bennük, ezért különböző a tömegük. A tömeg azt jelenti, hogy mennyi anyag van egy testben; az izotópok esetében a tömegkülönbség a nukleonok (protonok és neutronok) számának különbségéből adódik. Mivel a neutronok száma eltérő, ugyanazon elem különböző izotópjai különböző tömegszámúak és különböző fizikai tulajdonságokkal rendelkezhetnek.
Tömegszám és jelölés
Az izotópok azonos elem különböző változatai, ezért az atomszámuk — vagyis a protonok száma — megegyezik. Az atomszámot a protonok száma határozza meg, míg az izotópok megkülönböztetésére szolgáló fontos jellemző a tömegszám, amely a protonok és neutronok összegét adja. Az izotópok tömegszámáról gyakran az A betűvel beszélünk: A = Z + N (Z = protonok, N = neutronok).
Az izotópokat a vegyjel elé vagy fölé tett tömegszámmal jelöljük, például 12C vagy 12C a szén stabil izotópjára, illetve a hidrogén izotópjai: 1H (protium), 2H (deutérium) és 3H (trícium). A természetes elem relatív atomtömege pedig az adott izotópok bőségének súlyozott átlagából adódik.
Típusok, stabilitás és előfordulás
Az izotópok lehetnek stabilak vagy radioaktívak (radioizotópok). A radioaktív izotópok instabil maggal rendelkeznek, amely idővel bomlik, és közben sugárzást bocsát ki (alfa-, béta- vagy gamma-sugárzás). Például a szén-14 (14C) radioaktív izotópja a szén-dátumozás (radiokarbon módszer) alapja, mert felezési ideje körülbelül 5730 év. Másik példa: a trícium (3H) radioaktív, felezési ideje ~12,3 év. A deutérium (2H) viszont stabil.
Az egyes elemek több izotóppal rendelkezhetnek, amelyek természetes bőségükben nagyon eltérőek lehetnek. Néhány elemnek csak egy stabil izotópja van, másoknak több tucat stabil és/vagy radioaktív izotópja lehet.
Kémiai hatások és tömeghatás
Egy semleges atomban az elektronok száma megegyezik a protonok számával. Ugyanazon elem izotópjainak elektronszáma és elektronszerkezete is megegyezik, ezért a kémiai kötődésük és az alapvető kémiai tulajdonságaik szinte azonosak. Az atom kémiai viselkedését elsősorban az elektronok határozzák meg, így az izotópok általában ugyanazon reakciókban vesznek részt.
Ugyanakkor létezik a tömeghatás (kinetikai izotóphatás): a nehezebb izotópok reakciósebessége gyakran lassabb a könnyebb izotópokéhoz képest, mert nagyobb a tehetetlenségük és eltérő a kötési rezgésük. Ez a hatás különösen jól látható a protium (1H) és a deutérium (2H) közötti különbségnél, mivel a deutérium tömege gyakorlatilag kétszerese a protiumének. Nehézebb elemek esetén az izotópok közötti relatív tömegbeli különbség kisebb, így a tömeghatás általában kicsi, sokszor elhanyagolható.
Alkalmazások és példák
- Izotópjelölés és tracer-kutatás: stabil vagy radioaktív izotópokat használnak nyomjelzésre biológiában, kémiai mechanizmusok vizsgálatára és környezeti kutatásokra.
- Orvosi alkalmazások: bizonyos radioizotópokat diagnosztikára (pl. PET-vizsgálat, ahol gyakori az 18F), illetve sugárterápiára használnak.
- Éghajlat- és kormeghatározás: a szén-14 és más radioizotópok segítségével meghatározzák régészeti és geológiai minták korát.
- Energia és ipar: izotópokat használnak neutron-forrásként, illetve nukleáris energiatermelésben és anyagvizsgálatokban.
Összefoglalva: az izotópok ugyanannak a kémiai elemnek azok a változatai, amelyek azonos protonszámmal, de eltérő neutronszámmal rendelkeznek. Ez a különbség határozza meg a tömegszámukat, a nukleáris stabilitásukat és bizonyos fizikai tulajdonságaikat, miközben kémiai viselkedésük általában nagyon hasonló marad.
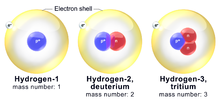
A hidrogén izotópjai
Stabilitás
Az atommagok protonok és neutronok, amelyeket a magerő tart össze.Mivel a protonok pozitív töltésűek, taszítják egymást. A neutronok, amelyek semlegesek, stabilizálják az atommagot. Mivel az atommagban vannak, a protonok kissé eltolódnak egymástól. Ez csökkenti a protonok közötti elektrosztatikus taszítást. Továbbra is vonzó magerőt gyakorolnak egymásra és a protonokra. Egy vagy több neutron szükséges ahhoz, hogy két vagy több proton egy magba kapcsolódjon. Ahogy a protonok száma nő, úgy nő a stabil atommaghoz szükséges neutronok száma is.
A természetben néhány elemnek csak egyetlen izotópja van. Például a fluor-19 (19F) a fluor egyetlen stabil izotópja a több közül. Más elemeknek több izotópjuk is van. A xenonnak például 9 izotópja van. A 81 stabil izotóppal rendelkező elem közül a legtöbb stabil izotóp bármely elem esetében tíz (az ón elem esetében).
Egyes izotópok radioaktívak. Ezeket nevezzük radioaktív izotópoknak. Mások nem radioaktívak. Ezeket stabil izotópoknak nevezzük.
A hidrogénnek három közös izotópja van. A hidrogén leggyakoribb izotópja a protium (1H). Az egy plusz neutronnal rendelkező (2 atomtömegű) hidrogénatomot deutériumnak (2H) nevezik. Az egy protonnal és két neutronnal rendelkező (3 atomtömegű) hidrogént tríciumnak (3H) nevezik. A protium és a deutérium stabil izotópok, míg a trícium radioaktív izotóp.
A periódusos rendszer legnehezebb elemei mind radioaktívak. A radon, a tórium és az urán összes izotópja radioaktív, mivel nagyon nehéz. Ez azért van, mert az atommagban lévő nukleáris erők nehezen tudják összetartani a sok proton és neutron által alkotott részecskéket.
Kapcsolódó oldalak
- Izotópos elektrokémia
Kérdések és válaszok
K: Mik azok az izotópok?
V: Az izotópok egy kémiai elem atomjainak különböző típusai, amelyek nagyon hasonló viselkedésűek, de különböző tömegűek.
K: Miben különböznek az izotópok egymástól?
V: Ugyanannak az elemnek az atomjai azonos számú protonokkal rendelkeznek, de a különböző izotópok különböző számú neutronnal rendelkeznek. Ennek következtében a tömegszámuk is eltérő, ami a protonok és a neutronok számából adódik.
K: Minden izotóp stabil?
V: Nem, egyes izotópok nem stabilak, ezért radioaktív bomlással más izotóppá vagy elemmé alakulnak át. Ezeket radioaktív izotópoknak, míg a többi nem radioaktív izotópot stabil izotópnak nevezzük.
K: Hogyan lehet egy izotópot azonosítani?
V: Egy izotópot általában az elem és tömegszámának megadásával neveznek meg. Például a szén-12 vagy 12C olyan atom, amelynek 6 protonja és 6 neutronja van, míg a szén-14 vagy 14C 8 neutronnal rendelkezik.
K: Mit jelent az "izotóp" kifejezés?
V: Az "izotóp" szó jelentése "ugyanazon a helyen", arra utalva, hogy ugyanazon elem minden atomja ugyanazon a helyen szerepel a periódusos rendszerben.
K: Miért van az olyan atomoknak, amelyeknek több neutronjuk van, nagyobb súlyuk, mint azoknak, amelyeknek kevesebb neutronjuk van?
V: A több neutronnal rendelkező atomok azért nehezebbek, mert további részecskéket (neutronokat) tartalmaznak, amelyek növelik az össztömegüket a kevesebb neutronnal rendelkezőkhöz képest.
Keres