Anfinsen-dogma: a fehérjék hajtogatásának elmélete és kivételei
Anfinsen-dogma: a fehérjék hajtogatásának elmélete és kivételei — prionok, amiloidok, Levinthal-paradoxon és kapcsolódó betegségek (Alzheimer, Parkinson) áttekintése.
Az Anfinsen-dogma egy molekuláris biológiai hipotézis, amelyet Christian Anfinsen kísérleti eredményeire alapozva fogalmaztak meg. Anfinsen munkája — különösen a ribonukleáz A enzim vizsgálata — azt mutatta, hogy bizonyos körülmények között a fehérje aminosavsorrendje önmagában tartalmazza a natív, biológiailag aktív szerkezet kialakításához szükséges információt. Kísérleteiben denaturálta az enzimet (például urea és redukáló szer használatával), majd ezek eltávolítása után a fehérje visszanyerte az eredeti konformációját és aktivitását — ezzel bizonyítva, hogy a primér szerkezet képes meghatározni a végső térelrendeződést.
Az Anfinsen-dogma három alapfeltétele
- Egyediség — a szekvencia egy egyedi, domináns energiaminimumú konformációhoz tartozik; nincs más, hasonló szabadenergiájú, stabil szerkezet, amely versengene vele.
- Stabilitás — a natív alak stabil marad a kisebb környezeti változások (hőmérséklet, pH stb.) hatására, tehát a natív állapot jól definiált energiaminimum.
- Kinetikus hozzáférhetőség — a fehérje eléri a natív alakot anélkül, hogy irreálisan hosszú vagy rendkívül összetett konformációs átmeneteken (például tartós csomókon) kellene áthaladnia.
Hogyan egyezteti a Levinthal-paradoxon?
A Levinthal-paradoxon rámutatott, hogy elméletileg egy fehérje összes lehetséges konformációjának végigpróbálása lehetetlenül sokáig tartana (még egy kis, ~100 aminosavból álló fehérje esetén is), így felmerül a kérdés, hogyan tud mégis gyorsan és megbízhatóan összehajtódni. A modern megértés ezt az ún. energiatölcsér (energy landscape) modelljével oldja fel: a konformációs tér nem egy teljesen lapos, hanem egy válaszfalakkal és lejtőkkel rendelkező folyó, ahol a hajtogatódás során a fehérje energiatöbblet csökkenése (lejtők) mentén „irányítottan” halad a natív állapot felé, elkerülve az összes lehetséges kombináció ezt-azt próba-szerű bejárását.
Kivételek és a sejtes valóság — miért nem teljesen univerzális a dogma?
Bár Anfinsen-kísérletei erősen alátámasztják, hogy a primér szerkezet nagy szerepet játszik a szerkezet meghatározásában, a sejten belüli környezet ennél összetettebb tényezőket is bevezet:
- Molekuláris segédproteinek (chaperonok) — a sejtekben számos gardedámokra van (molekuláris chaperonokra) szükség a helyes hajtogatódás elősegítéséhez és a hibás összecsavarodások megelőzéséhez. Ilyenek például a Hsp70 család és a GroEL/GroES rendszer; a chaperonok nem adják meg a végső szerkezetet, hanem csökkentik a hibás aggregációk esélyét és segítik a kinetikai akadályok leküzdését.
- Ko-transzlációs hajtogatódás — a fehérje már a riboszómán történő szintézis közben elkezdhet összehajtódni, ami befolyásolja a végső szerkezet kialakulását.
- Poszt-transzlációs módosítások és kémiai környezet — diszulfid-hidak képződése (és átalakulása), foszforiláció, glikoziláció és a sejten belüli ionikus környezet mind befolyásolhatja a hajtogatódást; ennek megfelelően fontos az olyan enzimek szerepe is, mint a protein disulfide isomerase vagy a peptidyl-prolyl izomerázok, amelyek a helyes kötésformákat segítik kialakítani.
- Membránfehérjék és oligomerizáció — membránba beágyazódó fehérjék és sok szubegységből álló komplexek összeállása gyakran nem írható le pusztán a monomer aminosavsorrendjéből anélkül, hogy figyelembe vennénk a lipidkörnyezetet és az asszociációs folyamatokat.
- Intrinzikusan rendezetlen fehérjék (IDP-k) — egyes fehérjék nem vesznek fel stabil, jól definiált szerkezetet monomer formában; funkciójuk gyakran a szerkezet dinamikus változásaira épül, illetve partnerkötéskor rendeződnek.
Prionok, amiloidok és patológiás kivételek
A prionok jól ismert kivételek az Anfinsen-elv általános értelmezése alól. A prionok olyan fehérjék, amelyek egy alternatív, stabil, önmagát templátként terjesztő konformációt vehetnek fel, és ennek következtében képesek a natív formát a kóros alakba „átprogramozni”. Ennek klinikai következményei a prionbetegségek, például a szarvasmarhák szivacsosagyvelőbántalma (kergemarhakór) és a humán megfelelői (pl. Creutzfeldt–Jakob-kór).
Más amiloidos betegségek, köztük az Alzheimer-kór és a Parkinson-kór, szintén annak a következményei lehetnek, hogy bizonyos fehérjék kóros aggregátumokat (amiloid fibrilleket) alkotnak, amelyek stabilabb alternatív szerkezetekhez vezetnek, és ezáltal nem illeszkednek az egyszerű Anfinsen-elvhez.
Összegzés — modern nézőpont
Az Anfinsen-dogma alapvető gondolata — hogy az aminosavsorrend meghatározza a fehérje háromdimenziós szerkezetét — ma is érvényes és nagyon hasznos elv. Ugyanakkor a sejtes környezet, a kinetikai akadályok, a segédfehérjék és bizonyos kóros vagy specializált fehérjecsoportok miatt a teljes kép ennél árnyaltabb: a biológiai rendszerekben a helyes hajtogatódást számos további tényező szabályozza és segíti.
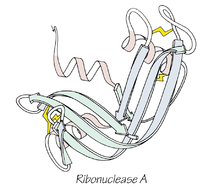
A ribonukleáz A összehajtogatott, 3-D szerkezete
Kérdések és válaszok
K: Mi az Anfinsen dogma?
V: Az Anfinsen-dogma egy Christian Anfinsen által javasolt hipotézis a molekuláris biológiában, amely szerint a fehérje natív szerkezetbe történő összehajlását a fehérje aminosavsorrendje automatikusan végzi.
K: Mi az egyediség, a stabilitás és a kinetikus hozzáférhetőség három feltétele?
V: Az egyediség megköveteli, hogy a szekvenciának ne legyen más, hasonló szabad energiájú konfigurációja. A stabilitás azt jelenti, hogy a környező környezet kis változásai nem okozhatnak változásokat a minimális konfigurációban. A kinetikai hozzáférhetőség azt jelenti, hogy a végső alakzatot anélkül lehet elérni, hogy az alakzatban nagymértékben bonyolult változásokon menne keresztül (mint például a csomók).
K: Mi a Levinthal-paradoxon?
V: A Levinthal-paradoxon azt állítja, hogy egy adott fehérje számára elérhető lehetséges konformációk száma csillagászatilag nagy, olyannyira, hogy még egy kis, 100 maradékból álló fehérje esetében is több időre lenne szükség, mint amennyi az univerzum létezett ahhoz, hogy az összes lehetséges konformációt feltárja (1026 másodperc) és kiválassza a megfelelőt.
K: Vannak kivételek Anfinsen dogmája alól?
V: Igen, a prionok és az amiloid betegségek, mint például a szarvasmarhák szivacsos agyvelőbántalma (kergemarhakór), az Alzheimer-kór és a Parkinson-kór kivételek Anfinsen dogmája alól.
K: Hogyan nyerte el Christian Anfinsen a Nobel-díját?
V: Christian Anfinsen a kémiai Nobel-díjat a ribonukleáz A enzim szerkezetével kapcsolatos munkájáért kapta.
K: Miben különböznek a prionok a natív hajtogatási állapottól?
V: A prionok a fehérjék stabil konformációi, amelyek eltérnek a natív hajtogatási állapottól.
Keres