Enolok: definíció, tautomerizmus, enolátok és aldolreakció
Enolok: definíció, tautomerizmus, enolátok és aldolreakció — részletes magyarázat, előállítás, kinetikus és termodinamikai enolátok, reakciómechanizmusok és példák.
Az enol olyan alkén, amelynek kettős kötés egyik végéhez egy OH-csoport kapcsolódik. Az enolok képlete általában R-CH=CH-OH vagy R2C=CH-OH típusú lehet, attól függően, hogy milyen szubsztituensek kapcsolódnak a kettős kötéshez. Enolátnak nevezzük, ha az oxigénatomon lévő protont elvettük; ekkor az oxigén negatív töltésű lesz és az ion elektromos töltéssel rendelkező reakcióképes nukleofilként viselkedik.
Tautomerizmus: keto–enol egyensúly
Az enolok ketonok vagy aldehidek tautomerjei. A tautomerek olyan molekulák, amelyek csak egy hidrogénatom helyzetében különböznek egymástól — itt az alpha-hidrogén vándorol a karbonil-szén és az oxigén között. A keto–enol egyensúly rendszerint a keto forma felé tolódik, mert a C=O kötés erősebb és stabilabb, mint a C=C kötés.
Az egyensúlyt befolyásolják:
- szubsztituensek (elektronvonzó csoportok stabilizálják az enolt/enolátot),
- konjugáció (például a rendszer konjugált kettős kötésekhez kapcsolódik),
- intra- vagy intermolekuláris hidrogénkötések (például β-diketonok enol formája stabil, mert erős intramolekuláris H-kötést tud kialakítani),
- oldószer (poláris protikus oldószerek protonálhatják/deprotonálhatják),
- hőmérséklet.
Például bizonyos β‑diketonok (mint az acetil-aceton) jelentős részben enol formában találhatók meg az intramolekuláris H‑kötés és a konjugáció miatt.
Enolizáció: hogyan jön létre enol vagy enolát?
Az enolok két fő úton keletkezhetnek: savkatalizált és báziskatalizált enolizációval.
- Savkatalízis: a karbonil‑oxigén protonálódik, ezáltal a szomszédos alfa‑hidrogén könnyebben eltávolítható, majd az alfa‑szénről történő deprotonálás eredményeként alakul ki az enol. Ez a mechanizmus általában reverzibilis és sok esetben gyors.
- Báziskatalízis: erős bázis (például alkoxidok, ≥LDA) eltávolítja az alfa‑hidrogént, közvetlenül enolát (azaz deprotonált enol) keletkezik. Az enolát erős nukleofil, és fémionokkal (pl. Li+, Na+, K+) komplexet képezhet.
Az alfa‑hidrogének savassága mérsékelt: tipikus ketonok pKa‑értéke vízben körülbelül 19–21, de az effektív savasságot nagyban befolyásolja az oldószer és a szubsztituensek. Erős, kis molekulatömegű bázisok (pl. LDA — lithum diizopropilamid) alacsony hőmérsékleten gyorsan eltávolítják a legkönnyebben hozzáférhető alfa‑hidrogént, míg gyengébb vagy sterikusan nagy bázisok más eredményt hoznak.
Enolátok: szerkezet és reaktivitás
Az enolátok rezonanciafelírata szerint a negatív töltés részben az oxigénen, részben az alpha‑szén atomon delokalizálódik. Ennek következtében kétféle reaktivitási helyet találunk:
- O‑alkilezés/oxygen attack: amikor az enolát oxigénje reagál (gyors, de gyakran reverzibilis),
- C‑alkilezés/carbon attack: amikor az alfa‑szén nukleofil reakciókat ad (sokszor kívánt, pl. alkilezésnél).
A fémkation (Li+, Na+, K+) jellege és az oldószer befolyásolja, hogy az enolát inkább O‑ vagy C‑alkileződésre hajlamos. Például poláris, protikus oldószerben és nagyobb fémeknél gyakrabban jelentkezik O‑alkilezés; koordináló oldószerek (THF, éter) és Li+ mellett gyakran érvényesül a C‑alkilezés.
Kinetikus és termodinamikai enolátok
A ketonok enoljai két különböző oldalon készülhetnek, ha aszimmetrikus a molekula. Fontos, hogy ki tudjuk választani, melyik oldalra reagáljunk. A kevesebb szubsztituenssel rendelkező oldalt a legkönnyebb reagáltatni: alacsony hőmérsékleten, terjedelmes bázissal előállítható. Ezt nevezzük kinetikus enolátnak. A másik, több szubsztituenssel rendelkező oldalt nehezebb reakcióba hozni; magasabb hőmérsékletre van szükség, és ez adja a termodinamikai enolátot, amely általában stabilabb (alacsonyabb szabadenergiájú) a jobb szubsztituáltság vagy konjugáció miatt.
Gyakorlati példa: LDA −78 °C-on gyakran adja a kinetikus enolátot; míg gyenge, hőmérséklet alatt equilibrationre hajlamos bázisok és melegebb körülmények a termodinamikai enolátot hozzák létre.
Fontos reakciók, amelyekben enolok/enolátok részt vesznek
Az enolok és enolátok számos alapvető szén‑szén és szén‑heteroatom kötésképző reakció központjai:
- Aldolreakció: az enolát nukleofil módon megtámad egy másik karbonil‑csoportot, C–C kötés kialakulását eredményezve. Lehet önaldol (azonos vegyületek között) vagy keresztaldol (különböző keton/aldehid között). Intramolekuláris változatai fontosak gyűrűk képzésében (pl. Robinson annulation).
- Claisen kondenzáció: enolátok és észterek reakciója C–C kötést hoz létre (β‑ketoészterek képződése).
- Michael‑addíció: enolátok konjugált akceptorokhoz (α,β‑telített enonokhoz) adódnak, β‑szubsztitúciót eredményezve.
- Alpha‑halogenálás és alpha‑oxidáció: az enol vagy enolát alfa‑pozíciójának elektrofili halogénezése/oxigenálása.
- Alkilálás: megfelelő feltételek mellett az enolátok karbonfelületén alkilező szerekkel (pl. alkil-halogenidek) C‑alkilezés érhető el. Az O‑alkilezés elkerülése gyakran gondos ionpár‑ és oldószerválasztást igényel.
- Silyl enol‑éterek: enolokat gyakran "védik" silyl enol‑éterekké (pl. TMS-enoléterek), melyek stabilabbak és jól kontrollálható reaktivitást adnak a további funkcionálásoknál.
Gyakorlati megjegyzések és stratégiák
- Bázis kiválasztása: LDA, LiHMDS, NaHMDS alkalmasak erősen szelektív, kinetikus enolátképzésre; KOtBu vagy más sterikusan kiszorító bázisok más eredményt adhatnak.
- Hőmérsékleti kontrol: alacsony hőmérséklet előnyös a kinetikus controlhoz, míg melegebb körülmények az equilibrationt és a termodinamikai termék kialakulását segítik.
- Oldószerek és fémionok: koordináló oldószerek (THF, diéterek) és a fémion típusa befolyásolják a reaktivitást és a C‑ vs O‑alkilezési szelektivitást.
- Stabilizált enolátok: elektronvonzó csoportok (pl. karbonil csoportok) az alpha‑pozíción jelentősen növelik a proton savasságát és az enolát stabilitását — ezért β‑diketonok, β‑keto‑észterek gyakran enol vagy enolát formában is stabilak.
Összefoglalás
Az enolok és enolátok a szerves kémia kulcsfontosságú reakcióközpontjai: a keto–enol tautoméria, az enolátok képzése és irányított felhasználása lehetővé teszi új C–C és C–heteroatom kötések kialakítását. A reakciók szelektivitása (kinetikus vs termodinamikai, C‑ vs O‑alkilezés) nagymértékben függ a bázistól, hőmérséklettől, oldószertől és a fémiontól, ezért a megfelelő feltételek megválasztása kísérletileg különösen fontos.
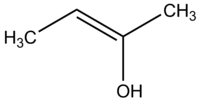
Egy enol
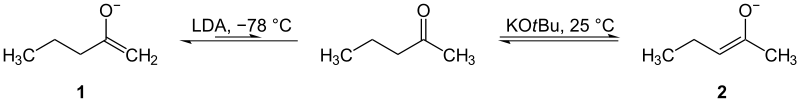
Kinetikai (1) és termodinamikai (2) enolátumok
Kérdések és válaszok
K: Mi az az enol?
V: Az enol egy olyan alkén, amelynek kettős kötés egyik végéhez egy OH-csoport kapcsolódik.
K: Mi az enolát?
V: Az enolát olyan enol, amelynek oxigénatomjáról eltávolították a protont.
K: Mik a tautomerek?
V: A tautomerek olyan molekulák, amelyek csak egy hidrogénatom helyzetében különböznek.
K: Hogyan állíthatók elő enolok ketonokból vagy aldehidekből?
V: Ketonokból vagy aldehidekből bázis segítségével könnyen előállíthatók enolok.
K: Miért instabilak az enolok?
V: Az enolok azért instabilak, mert a C=O kötés erősebb, mint a C=C kötés.
K: Mi az aldolreakció?
V: Az aldolreakció egy érdekes reakció, amelyet enolokkal lehet végrehajtani.
K: Hogyan lehet egy enol kevesebb szubsztituenssel rendelkező oldalát reakcióra bírni?
V: Egy enol kevesebb szubsztituenssel rendelkező oldala, az úgynevezett kinetikus enolát, alacsony hőmérsékleten egy terjedelmes bázissal reakcióra készíthető.
Keres