Hidrogén izotópjai: definíció és áttekintés — protium, deutérium, trícium
Hidrogén izotópjai: átfogó áttekintés a protiumról, deutériumról és radioaktív tríciumról — tulajdonságok, alkalmazások és stabilitás egyszerűen.
A hidrogénnek három fő izotópja van: a protium (1H), a deutérium (2H) és a trícium (3H). Ezek az izotópok abban különböznek egymástól, hogy hány neutron található az atommagban: a protiumnak nincs neutronja (csak egy proton), a deutériumnak egy neutronja van, a tríciumnak pedig két neutronja. A protium és a deutérium stabil izotópok, míg a trícium radioaktív — felezési ideje körülbelül 12,32 év — és bétabomlással visszaalakul 3He-vá.
Nevek és jelölések
A hidrogén fő izotópjai különlegesek abban is, hogy saját nevük van: protium, deutérium és trícium. A deutériumot és a tríciumot gyakran rövidítik D-vel és T-vel; ezek a jelölések széles körben használatosak a gyakorlatban. A Nemzetközi Tiszta és Alkalmazott Kémiai Unió (IUPAC) azonban hivatalos, formális kontextusban előnyben részesíti a tömegszámos jelölést (2H, 3H), bár a D és T megnevezések nem tűntek el a szakirodalomból.
Fizikai és kémiai következmények
A neutronszám különbsége a tömegekben és így a mozgási tulajdonságokban is jelentkezik, ami kémiai viselkedésre is hatással van. A deutérium tömege majdnem kétszerese a protiumének, ez:
- izotópikus eltolódást eredményez a spektrumokban (pl. infravörös rezgések),
- kinetikai izotóphatást okoz — kémiai reakciókban a kötésbontás lassabb lehet deutériummal, ezért a deutériumot mechanizmusvizsgálatokhoz és farmakokinetikai kutatásokhoz használják,
- a deutériummal képzett nehézvíz (D2O) fizikai tulajdonságai eltérnek a sima vízétől (pl. olvadáspont és forráspont eltérései), és különleges szerepe van nukleáris technológiákban.
Előfordulás és előállítás
A természetes hidrogén legnagyobb része protium: a földi vizekben a deutérium aránya kis töredék, körülbelül 150–160 ppm (0,015–0,016%). A trícium természetes mennyisége rendkívül alacsony; emellett kozmikus sugárzás és légköri folyamatok is létrehoznak nyomnyi tríciumot. Az ipari és kutatási célokra deutériumot és tríciumot különböző módszerekkel állítanak elő:
- deutériumot általában a víz elektrolízisével vagy lepárlással dúsítanak, így nyerik a nehézvizet (D2O),
- tríciumot elsősorban nukleáris reaktorokban vagy részecskegyorsítókban állítják elő neutronbefogással és más nukleáris reakciókkal; a trícium forrásai lehetnek továbbá nukleáris fegyverpróbák és bizonyos ipari tevékenységek.
Felhasználások
A hidrogénizotópok számos gyakorlati területen fontosak:
- Deutérium (D, 2H): neutronmoderátorként és hűtőközegként a nehézvizes reaktorokban (pl. CANDU); izotópdúsító anyagként és tracerként kémiai és biokémiai kutatásokban; NMR- és spektroszkópiai alkalmazásokban (oldószerként deutériált oldószereket használnak).
- Trícium (T, 3H): radioaktív tracerként biológiai és környezeti vizsgálatokban; önvilágító eszközökben (kis fényforrások, jelölők) speciális, zárt tartályokban; potenciális fúziós üzemanyagként (DT-reakciók, ahol deutérium és trícium egyesülve nagy energiát adnak).
- Protium (1H): minden „hagyományos” víz és szerves vegyület alkotóeleme, alapvető szereplő a kémiai és biológiai folyamatokban.
Biztonság és környezeti vonatkozások
A trícium radioaktivitása miatt kezelése, tárolása és kibocsátása szigorú szabályozás alá esik. A trícium béta-sugárzása alacsa energiájú, így külső sugárzásként általában kevésbé veszélyes, de belélegzés, lenyelés vagy bőrön át történő felvétel esetén belső sugárterhelést okozhat. A nehézvíz kémiai értelemben nem mérgező kis koncentrációban, de biológiai rendszerekben a hidrogén helyettesítése nagy arányban hatással lehet az élőlények működésére.
Mesterséges, rövid élettartamú izotópok
A tudósok további hidrogénizotópokat is előállítottak: 4H–7H. Ezek rendkívül instabilak, nagyon rövid felezési időkkel rendelkeznek, és a természetben nem találhatók meg; jellemzően gyorsan szétesnek neutronkibocsátással vagy más bomlási módokkal. Ezeknek az izotópoknak elsősorban alapkutatási jelentőségük van a nukleáris szerkezet és erős kölcsönhatások vizsgálatában.
A hidrogén izotópjai tehát nemcsak alapvető tudományos érdeklődés tárgyai, hanem fontos gyakorlati szerepet is betöltenek az energiatermelésben, a kutatásban és ipari alkalmazásokban.
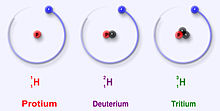
A hidrogén három legstabilabb izotópja
Protium (hidrogén-1)
A protium a hidrogén leggyakoribb izotópja. A világegyetemben található összes hidrogén több mint 99,98%-át teszi ki. Azért nevezték el protiumnak, mert atommagjában csak egy proton van. A protium atomtömege 1,00782504(7) u. A protium jelképe 1H.A protium protonja még soha nem bomlott el egy megfigyelés során, ezért a tudósok úgy vélik, hogy a protium stabil izotóp. A részecskefizika új elméletei azt jósolják, hogy a proton bomolhat, de ez a bomlás nagyon lassú. A proton felezési ideje állítólag 1036 év. Ha a proton bomlása igaz, akkor az összes többi stabilnak mondott atommag valójában csak megfigyelési szempontból stabil, azaz stabilnak látszik. A legújabb kísérletek kimutatták, hogy ha a protonbomlás valóban bekövetkezik, akkor a felezési ideje 6,6 × 1033 év.
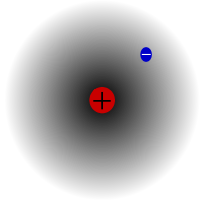
Protium, a hidrogén leggyakoribb izotópja. Különlegessége, hogy ez az egyetlen olyan izotóp, amelynek nincs neutronja.
Deutérium (hidrogén-2)
A deutérium, vagy 2H, vagy néha D, a hidrogén másik stabil izotópja. Az izotópnak egy protonja és egy neutronja van. A Földön található összes hidrogénatom körülbelül 0,0026-0,0184%-át teszi ki. A deutérium a Földön a hidrogéngázban kevesebb, a tengervízben viszont több (0,015% vagy 150 ppm). A deutérium nem radioaktív, és nem károsítja az élőlényeket. A deutérium vízmolekulákat is képes alkotni. A protium helyett deutériumot tartalmazó vizet nehézvíznek nevezik.
Tritium (hidrogén-3)
A trícium (3H) a hidrogén legstabilabb radioizotópja. Vagyis a hidrogén összes radioaktív izotópja közül a trícium a legkevésbé radioaktív. Magjában egy proton és 2 neutron található. A trícium béta-mínusz bomlással bomlik, és hélium-3-á alakul. Felezési ideje 12,32 év.A trícium a természetben a felső légkör gázai és a kozmikus sugárzás közötti kölcsönhatás során keletkezik. A nukleáris fegyverek tesztelése során is keletkezik. A tríciumot és a deutériumot a csillagokban a D-T magfúzióban használják fel, hogy sok energiát adjanak ki.
Kérdések és válaszok
K: Hány fő izotópja van a hidrogénnek?
V: A hidrogénnek három fő izotópja van: a protium, a deutérium és a trícium.
K: A protium és a deutérium stabil izotópok?
V: Igen, a protium és a deutérium stabil izotópok.
K: Mennyi a trícium felezési ideje?
V: A trícium radioaktív, felezési ideje körülbelül 12 év.
K: Hány más hidrogénizotópot hoztak létre a tudósok?
V: A tudósok négy másik hidrogénizotópot hoztak létre: 4H-tól 7H-ig.
K: Ez a négy további hidrogénizotóp létezik a természetben?
V: Nem, ezek az izotópok nagyon instabilak, és a természetben nem léteznek.
K: Mi teszi egyedivé a hidrogén fő izotópjait?
V: A hidrogén fő izotópjai azért egyedülállóak, mert ezek az egyetlen izotópok, amelyeknek nevük is van.
K: A deutériumnak és a tríciumnak van saját szimbóluma?
V: Igen, a deutérium és a trícium néha saját szimbólumokat kap: D és T. A Nemzetközi Tiszta és Alkalmazott Kémiai Unió azonban nem nagyon szereti ezeket a neveket, annak ellenére, hogy gyakran használják őket.
Keres