Izolobális elv (analógia): definíció, példák és alkalmazások
Ismerd meg az izolobális elv definícióját, gyakorlati példáit és alkalmazásait a fémorganikus kémiában — Hoffmann analógiáját és reakcióképesség-előrejelzést.
Az izolobális elv (más néven izolobális analógia) a fémorganikus vegyületek kötési tulajdonságainak előrejelzésére szolgáló módszer. A fémorganikus kémiában a szerves ligandumok szerkezetével kapcsolatos, amelyek szervetlen molekulatöredékekhez képesek kötődni. Roald Hoffmann a molekuláris fragmentumokat izolobálisként írta le: „ha a határpályák száma, szimmetriatulajdonságai, közelítő energiája és alakja, valamint a bennük lévő elektronok száma hasonló — nem azonos, de hasonló”. Egy kevésbé ismert darab kötését és reakcióképességét megjósolhatjuk egy jobban ismert darabéból, ha a két molekuladarabnak hasonló határpályái vannak, különös tekintettel a legmagasabb elfoglalt molekuláris orbitálra (HOMO) és a legalacsonyabb nem elfoglalt molekuláris orbitálra (LUMO). Az izolobális vegyületek az izoelektronos vegyületek analógjai, amelyeknek azonos a valenciaelektronok száma és szerkezete. Az izolobális szerkezetek grafikus ábrázolása, ahol az izolobális párokat egy kétfejű nyíl köti össze, alatta egy fél orbitállal, az 1. ábrán látható.
Mit jelent gyakorlatban az izolobalitás?
Röviden: két molekulafragmentum izolobális, ha a határpályáik (frontier orbitals) számában, alakjában és szimmetriájában, valamint az azokban lévő elektronokban hasonlóság mutatkozik. Ez a hasonlóság lehetővé teszi, hogy egy jól ismert fragmentum viselkedése alapján következtessünk egy kevésbé ismert fragmentum kötési módjára és reaktivitására. Fontos azonban, hogy az izolobális analógia nem állítja, hogy a fragmentumok teljesen azonosak — csupán hogy a kémiai szerepükben hasonló viselkedés várható.
Példák (általánosabb megfogalmazás)
- Alkil- vagy alkilgyökök (például •CH3) és bizonyos átmenetifém-fragmentumok között gyakran találunk izolobális párhuzamokat: mindkettő rendelkezhet egy vagy több félbevágott határpályával, amelyek hasonló kötési geometriát eredményeznek.
- Két elektronos kötések és megfelelő fém–ligand fragmentumok: egy egyszerű H–H kötés vagy egy σ-kötő ligandum analóg viselkedést mutathat olyan metalocén- vagy karbonyltípusú fragmentumokkal, amelyeknek pályái hasonló szimmetriájúak és energiaszintűek.
- Általánosabb formában gyakran összevethetőek szerves és szervetlen darabok: egyszerű szénvegyületek fragmentumai ↔ bizonyos fémfragmentumok — ez a fajta párhuzam megkönnyíti új komplexek és reakciómechanizmusok elképzelését.
Alkalmazások
- Szerkezet- és reakciópredikció: új fémorganikus vegyületek kötési módjának és lehetséges reakcióútjainak előrejelzése.
- Katalízis tervezése: katalitikus ciklusok tervezésekor izolobális analógiák segítenek az aktív helyek és köztesek lehetséges viselkedésének feltárásában.
- Ligand- és molekulaépítés: izolobális gondolkodás használható „moduláris” építkezésnél: egy ismert fragmentum helyett izolobálissal helyettesítve hasonló szerkezet hozható létre.
- Oktatás és intuíció fejlesztése: az izolobális elv egyszerű, vizuális analógiát kínál, amely segíti a hallgatókat és kutatókat a komplex molekuláris pályák és kötések megértésében.
- Számításos kémia és modellépítés: kvantumkémiai számításokban izolobális feltételezések alapján egyszerűsítések hajthatók végre, ami gyorsabb előzetes becsléseket tesz lehetővé.
Korlátok és kritikák
- Az izolobális analógia egyszerűsített modell: elsősorban a határpályák hasonlóságára épít, ezért nem veszi teljes mértékben figyelembe a sterikus hatásokat, elektroditást, töltéseloszlást vagy a térszerkezetből eredő tényezőket.
- Energetikai különbségek: ha a pályák energiája jelentősen eltér, akkor a formális izolobalitás ellenére a kémiai viselkedés eltérő lehet.
- Specifikus esetekben kudarcot vallhat: Hoffmann is hangsúlyozta, hogy hasznos, de nem univerzális modell — egyes rendszerekben a finom elektronikai vagy kvantummechanikai részletek meghatározóbbak.
- Nem helyettesíti a részletes számításokat vagy kísérleti vizsgálatokat: az izolobális analógia inkább iránymutató, mint egzakt predikció.
Hogyan használjuk a gyakorlatban?
- Először azonosítsuk a vizsgált fragmentum határpályáit (HOMO/LUMO), azok számát és szimmetriáját.
- Keressünk jól ismert fragmentumokat, amelyek rendelkeznek hasonló pályajellemzőkkel.
- Vegyük figyelembe a geometriai és elektronikus különbségeket (sterikus tényezők, töltés, ligandumok hatása), mielőtt konkrét szintézis- vagy reakcióterveket alkotnánk.
- Az izolobális feltételezést mindig teszteljük számítással vagy kísérlettel, különösen, ha új katalizátorok vagy reaktív köztesek tervezéséről van szó.
Történet és irodalom
Az izolobális analógiával kapcsolatos munkájáért Hoffmann 1981-ben megkapta a kémiai Nobel-díjat, amelyet Kenichi Fukuival közösen osztott meg. Nobel-díjas előadásában Hoffmann hangsúlyozta, hogy az izolobális analógia hasznos, de egyszerű modell. A fogalom napjainkban továbbra is fontos szerepet játszik a fémorganikus kémia elméleti és gyakorlati oldalán, különösen a molekuláris tervezés és a katalízis területén.
Összefoglalva: az izolobális elv értékes intuíciót ad a különböző molekulafragmentumok közötti analógiák felismeréséhez, segít új szerkezetek és reakciók elképzelésében, de alkalmazásakor mindig vegyük figyelembe a modell korlátait és szükség esetén egészítsük ki részletes számításokkal vagy kísérleti adatokkal.
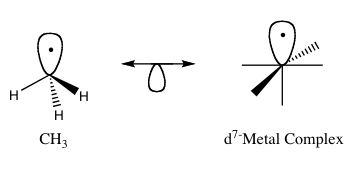
1. ábra: Az izolobális analógia alapvető példája.
Kérdések és válaszok
K: Mi az az izolobális elv?
V: Az izolobál-elv (más néven izolobál-analógia) a fémorganikus vegyületek kötési tulajdonságainak előrejelzésére szolgáló módszer. A szervetlen molekulaelemekhez kötődni képes szerves ligandumok szerkezetét a legmagasabb elfoglalt molekuláris orbitáljuk (HOMO) és a legalacsonyabb nem elfoglalt molekuláris orbitáljuk (LUMO) összehasonlításával hozza összefüggésbe.
K: Ki javasolta az izolobális elvet?
V: Roald Hoffmann javasolta az izolobális elvet.
K: Hogyan kapcsolódik az izoelektronikus vegyületekhez?
V: Az izolobális vegyületek az izoelektronikus vegyületek analógjai, amelyeknek azonos a valenciaelektronok száma és szerkezete.
K: Mit kapott Hoffmann az ezzel a koncepcióval kapcsolatos munkájáért?
V: Az izolobális analógiával kapcsolatos munkájáért Hoffmann 1981-ben megkapta a kémiai Nobel-díjat, amelyet Kenichi Fukuival közösen osztott meg.
K: Hogyan írta le Hoffmann a molekuláris töredékeket?
V: Hoffmann izolobálisnak nevezte a molekuladarabokat, "ha a határpályák száma, szimmetriatulajdonságai, közelítő energiája és alakja, valamint a bennük lévő elektronok száma hasonló - nem azonos, de hasonló".
K: Hogyan használhatjuk ezt a modellt a kötések és a reakcióképesség előrejelzésére?
V: Egy kevésbé ismert darabok kötését és reakcióképességét megjósolhatjuk egy jobban ismert darabokéból, ha hasonló határpályákkal rendelkeznek.
K: Ez a modell mindig helyesen működik?
V: Nem, bizonyos esetekben nem működik.
Keres