Makrofágok — szerep, működés és jelentőség az immunrendszerben
Makrofágok: hogyan működnek, szerepük az immunrendszerben, fagocitózis, gyulladás és adaptív válasz stimulálása — átfogó, közérthető útmutató.
A makrofágok a szövetekben található fehérvérsejtek, amelyek a monociták differenciálódásával jönnek létre.
A monociták és a makrofágok az általános immunitásban szerepet játszó fagociták. A gerincesek specifikus védekezési mechanizmusait (adaptív immunitás) is beindítják.
Feladatuk a sejtek és kórokozók fagocitálása (elnyelése, majd megemésztése) akár helyhez kötött, akár mozgó sejtek formájában. Emellett stimulálják a limfocitákat és más immunsejteket, hogy reagáljanak a kórokozóra,
Kialakulás, elhelyezkedés és fenntartás
A makrofágok két fő forrásból származhatnak: egy részüket a csontvelőben képződő monociták adják, amelyek a vérárammal eljutva a szövetekbe vándorolnak és ott differenciálódnak makrofággá. Másik csoportjuk a fejlődés korai szakaszában a magzati májból és a placentából származik, és a szövetekben tartósan helyben maradó (rezidens) populációt alkotják. A rezidens makrofágok példái: a microglia (agy), a Kupffer-sejtek (máj) és az alveoláris makrofágok (tüdő).
Funkciók és működés
- Fagocitózis: idegen részecskék, baktériumok, elöregedett sejtek bekebelezése és emésztése (lizoszomális enzimrendszerekkel).
- Antigénprezentáció: feldolgozzák a kórokozók antigénjeit és MHC II molekulákon keresztül bemutatják a CD4+ T-sejteknek, ezzel kapcsolva össze az innát és az adaptív immunválaszt.
- Cytokin- és kemokintermelés: szabályozzák a gyulladás mértékét és sejtek toborzását (pl. TNF-α, IL-1, IL-6, IL-10, chemokinek).
- Tisztítás és szöveti regeneráció: apoptotikus sejtek eltakarítása (efferocytosis), mátrix-átépítés és sebgyógyulás elősegítése.
- Vas anyagcseréje és homeosztázis: részt vesznek a vas recirkulációjában és egyéb metabolikus folyamatokban.
Polarizáció — M1 és M2 típusok
A makrofágok nagyfokú plaszticitással rendelkeznek: a környezeti jelzések hatására különböző aktivációs állapotokba kerülnek. Egyszerűsítve két szélső póz különíthető el:
- M1 (klasszikusan aktivált): proinflammatorikus, mikrobaölő; jellemző rá a nagy ROS és NO-termelés, IL-12 és TNF-α kibocsátás. Aktiválja őket pl. IFN-γ és patogén minták (PAMP-ok) felismerése TLR-eken keresztül.
- M2 (alternatívan aktivált): gyulladást csillapító, szövetregeneráló; IL-10 és TGF-β termelés jellemzi, részt vesz a sebgyógyulásban és a remodellingben. IL-4 és IL-13 serkentik kialakulását.
Valóságban a makrofágok spektrumként viselkednek, sok köztes állapottal és funkcióval (pl. tumor-asszociált makrofágok, TAM-ok, amelyek gyakran immun-szuppresszív hatásúak a daganatok környezetében).
Molekuláris és sejtfelszíni jellemzők
A makrofágok különféle receptorokkal ismerik fel a kórokozókat és a sérült sejteket: PRR-ek (pl. TLR-ek), Fc-receptorok (antitestekhez kötődve elősegítik a fagocitózist), komplementreceptorok és scavenger receptorok. Gyakran használt markerek a vizsgálatokban: CD14, CD68, CD163, CD206, valamint MHC II molekulák.
Szerep betegségekben és klinikai jelentőség
- Fertőzések: alapvető az akut immunválaszban; bizonyos kórokozók (pl. Mycobacterium tuberculosis) képesek a makrofágokon belül túlélni.
- Gyulladásos és autoimmun betegségek: túlzott vagy elhúzódó makrofág-aktiváció krónikus károsodáshoz vezethet (pl. reumatoid arthritis, gyulladásos bélbetegségek).
- Atherosclerosis: makrofágok veszik fel az oxidált LDL-t, kialakulnak a „habos sejtek” és hozzájárulnak az érelmeszesedéshez.
- Daganatok: TAM-ok lehetnek daganat-ellenesek vagy daganatot támogatóak; ma intenzív kutatás tárgya a makrofágokat célzó terápiás megközelítések (pl. aktiválás a tumor-ellenes állapotba, vagy szelektív gátlás).
- Gyógyszerfejlesztés és terápiák: ellenanyag-alapú kezelések, kis molekulák, valamint kísérleti módszerek (CAR‑M, klodronát liposzómák makrofág-deplecióra) célpontja lehetnek a makrofágok.
Módszertani megközelítések
A makrofágok vizsgálatához gyakori módszerek: immunhisztokémia, flow cytometry sejtfelszíni markerekre, transzkriptomikai elemzések (RNA‑seq) és funkcionális vizsgálatok (fagocitózis, citokintermelés mérés). In vitro gyakran monocyte-to-macrophage differenciálódást modelleznek citokinekkel (pl. M-CSF, GM-CSF).
Összefoglalva, a makrofágok sokoldalú, kulcsfontosságú sejtjei az immunrendszernek: közvetlenül eltávolítják a kórokozókat és a törmeléket, vezetik és modulálják a gyulladásos választ, kapcsolatot teremtenek az innát és az adaptív immunitás között, valamint fontos szerepet játszanak a szöveti homeosztázisban és a betegségek kialakulásában. Rugalmasságuk és polarizációjuk miatt mind alapkutatásban, mind klinikumban kiemelt jelentőségűek.
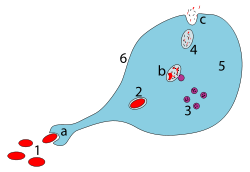
A kórokozót bekebelező makrofág lépései: a. Fagocitózissal történő bekebelezés, fagoszóma képződik. b. A lizoszómák fúziója a fagoszómával; a kórokozót enzimek bontják le. c. A hulladékanyag kilökődik vagy asszimilálódik (ez utóbbi nem látható a képen). Alkatrészek: 1. Kórokozók 2. Fagoszóma 3. Lysoszómák 4. Hulladékanyag 5. Citoplazma 6. Sejtmembrán
Életciklus
Amikor egy monocita az érfalon keresztül a sérült szövetbe jut, makrofággá alakul. A monocitákat kémiai anyagok vonzzák a sérült helyre, amelyeket különböző ingerek váltanak ki. Bizonyos helyeken, például a herében a makrofágok a proliferáció révén benépesítik a szervet.
A rövid életű neutrofilekkel ellentétben a makrofágok hosszabb ideig, akár több hónapig is életben maradnak a szervezetben.
Keres