Autofágia - a sejtek önemésztése: mechanizmus, szerepe és jelentősége
Autofágia: hogyan emészti és újrahasznosítja a sejt saját alkotóit? Ismerd meg a mechanizmust, szerepét az egészségben, öregedésben és betegségekben.
Az autofágia (ami azt jelenti, hogy "megeszi magát") az egyik alapvető sejtmechanizmus. Lehetővé teszi a nem működő vagy nem szükséges sejtrészek szabályozott lebontását. A sejtrészek ezután szükség szerint újrahasznosíthatók.
Ez többféleképpen is megtörténhet. A megcélzott sejtrészek elszigetelődhetnek a sejt többi részétől egy autofágoszómában (egy kettős membránnal rendelkező vezikulában). Az autofagoszóma összeolvad a lizoszómákkal, és a tartalmat lebontják és újrahasznosítják. Az éhezés szélsőséges eseteiben a sejtalkotók lebontása a sejtek túlélését segíti elő a sejtek energiaszintjének fenntartásával.
Az "autofágia" elnevezést Christian de Duve belga biokémikus alkotta meg 1963-ban. Az autofágiával kapcsolatos gének azonosítása az élesztőben az 1990-es években lehetővé tette a kutatók számára az autofágia mechanizmusainak megismerését. Ez vezetett ahhoz, hogy 2016-ban Yoshinori Ohsumi japán kutató megkapta a fiziológiai vagy orvosi Nobel-díjat.
Az autofágia típusai
- Makroautofágia: a legismertebb forma, amelyben az autofagoszómák körbeveszik a célpontot, majd összefonódnak a lizoszómákkal. Gyakran egyszerűen "autofágiának" nevezik.
- Mikroautofágia: a lizoszóma saját membránja közvetlenül bekebelezi a cytoszol egy részét; kisebb, nem szelektív folyamat.
- Káparon-asszisztált autofágia (chaperone-mediated autophagy, CMA): szelektív, ahol specifikus proteinek hőtchaperonok segítségével közvetlenül kerülnek a lizoszóma belsejébe.
Molekuláris alapok és kulcsfehérjék
Az autofágia lefolyását sok gén és fehérje szabályozza. Ezek közül fontosabbak:
- ATG-fehérjék (autophagy-related proteins): az élesztőkutatásokból ismertek, alapvetőek az autophagoszóma képződéséhez.
- ULK1 komplex: az indukció korai lépéseit vezérli.
- Beclin-1 (BECN1) és VPS34: szerepük van a vezikula kezdeti kialakulásában és membránforgalomban.
- LC3 (MAP1LC3): a citoszolos LC3-I lipidálódik LC3-II-vé és beépül az autofagoszóma membránjába; gyakran használják az autofágia jelölésére.
- p62 / SQSTM1: egy adaptorfehérje, amely összeköti a szelektív célpontokat (pl. aggregált fehérjéket) és LC3-at; felhalmozódása az autofágia csökkenésére utal.
- PINK1 és Parkin: fontosak a mitofágiában (szelektív mitokondrium-eltávolítás).
Szabályozás: mikor és hogyan kapcsol be az autofágia?
Az autofágia szabályozása összefügg a sejt energia- és tápanyag-állapotával. Két fontos jelzőút:
- mTOR (mechanistic Target of Rapamycin): előnyösen működő tápanyag- és növekedési faktor-jelzés; aktív mTOR gátolja az autofágiát. Tápanyaghiány vagy rapamicin hatására mTOR aktivitása csökken, és az autofágia aktiválódik.
- AMPK: az alacsony energiastátusz (magas AMP/ATP arány) aktiválja az AMPK-t, amely serkenti az autofágiát, részben mTOR-elnyomáson keresztül.
Szelektív autofágia (példák)
Az autofágia nem mindig nonszelektív "anyaglebontás". Sok esetben célzottan távolít el meghatározott komponenseket:
- Mitofágia — sérült vagy felesleges mitokondriumok eltávolítása (PINK1/Parkin közreműködéssel).
- Xenofágia — belső vagy bejutott kórokozók (baktériumok, vírusok) célzott eltávolítása.
- Aggrephágia — fehérjeaggregátumok eltávolítása (pl. neurodegeneratív betegségekben fontos).
- Lipofágia — lipidcseppek lebontása; szerepe a sejtek lipid- és energia-anyagcseréjében.
Élettani szerepek
- Sejthomeosztázis fenntartása: minőségellenőrzés, hibás organellumok és fehérjék eltakarítása.
- Energiaellátás és tápanyag-recycling: éhezéskor alapvető szerep a túlélésben.
- Fejlődés és differenciáció: bizonyos fejlődési folyamatok autofágiára épülnek.
- Immunválasz: kórokozók eltávolítása, antigénprezentáció és gyulladás szabályozása.
- Öregedés és életfenntartás: az autofágia aktivitása összefügg az élettartammal különböző modellekben.
Klinikai jelentőség
Az autofágia zavara számos betegségben szerepet játszik:
- Neurodegeneratív betegségek (Alzheimer-, Parkinson-, Huntington-kór): a hibás fehérjeaggregátumok eltávolításának csökkenése hozzájárulhat a betegségprogresszióhoz.
- Rák: kettős szerep — kezdeti tumorfejlődésben tumor-szuppresszorként működhet (hibás komponensek eltávolítása), míg előrehaladott daganatokban a stressztűrés és túlélés elősegítésével támogathatja a daganatot.
- Fertőzések: egyes kórokozók elkerülik vagy manipulálják az autofágiát; mások ellen az autofágia védelmet nyújt.
- Anyagcsere-betegségek és kardiovaszkuláris rendellenességek: a lipofágia és a mitofágia zavara anyagcserezavarokhoz és szívbetegségekhez kapcsolódhat.
Ennek megfelelően az autofágiát célzó terápiák (autofágia-aktivátorok vagy -gátlók) intenzív kutatási területet jelentenek. Például a rapamycin és hasonló mTOR-gátlók aktiválják az autofágiát; míg a klorokin és hidroxiklorokin a lizoszómális funkciót gátolva csökkentik az autofágiás fluxust.
Laboratóriumi vizsgálatok és fogalmak
Az autofágia mérésénél fontos megkülönböztetni az autofagoszóma-képződés szintjét és az autofágiás fluxot (az autofágia teljes lefolyását a képződéstől a lebontásig). Gyakori módszerek:
- LC3-I → LC3-II átalakulás detektálása western blot segítségével.
- GFP-LC3 vagy mCherry-GFP-LC3 fluoreszcens markerrel történő vizualizáció (puncta képződés).
- p62/SQSTM1 szintjének mérése (felhalmozódás az autofágia csökkenésére utal).
- Elektronmikroszkópia az autofagoszómák közvetlen vizsgálatára.
- Lizoszómális gátlók (pl. bafilomicin A1) alkalmazása a flux vizsgálatához: így meg lehet különböztetni a fokozott képződést a csökkent lebontástól.
Fontos megjegyzések
Az autofágia gyakran sejtvédő mechanizmus, de bizonyos körülmények között hozzájárulhat a sejthalálhoz is (az ún. autofágikus sejthalál). A pontos hatás sok tényezőtől függ: sejttípustól, stressz jellegétől és időtartamától, valamint a sejtmikrokörnyezet állapotától.
Összefoglalva: az autofágia egy sokrétű, finoman szabályozott folyamat, amely alapvető szerepet játszik a sejtek minőségellenőrzésében, anyagcseréjében és túlélésében. A fenti molekuláris ismeretek és a 1990-es években végzett élesztőkutatások, valamint Yoshinori Ohsumi díjazása hozzájárultak ahhoz, hogy ma már világosan látható, milyen nagy jelentősége van az autofágiának az egészség és a betegség szempontjából.
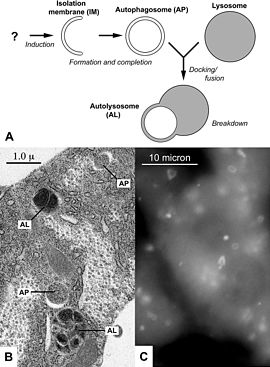
(A) Az autofágia ábrája; (B) Elektronmikroszkópos felvétel autofág struktúrákról egy gyümölcslégy lárva zsírtestében; (C) Fluoreszcensen jelölt autofagoszómák éheztetett egerek májsejtjeiben.
Kérdések és válaszok
K: Mit jelent az autofágia?
V: Az autofágia azt jelenti, hogy "felfalja önmagát".
K: Mi a célja az autofágiának?
V: Az autofágia célja, hogy lehetővé tegye a nem működő vagy nem szükséges sejtrészek ellenőrzött lebontását.
K: Hogyan bomlanak le a sejtrészek az autofágia révén?
V: A célzott sejtrészeket el lehet különíteni a sejt többi részétől egy autofágoszómában, amely összeolvad a lizoszómákkal, és tartalmuk lebomlik és újrahasznosul.
K: Milyen szélsőséges esetben segíti elő a sejtalkotók lebontása a sejt túlélését?
V: Az éhezés szélsőséges esetében a sejtkomponensek lebontása a sejtek energiaszintjének fenntartásával elősegíti a sejt túlélését.
K: Ki és mikor alkotta meg az "autofágia" kifejezést?
V: Christian de Duve belga biokémikus alkotta meg az "autofágia" kifejezést 1963-ban.
K: Mikor azonosították az autofágiával kapcsolatos géneket élesztőben?
V: Az élesztőben az autofágiával kapcsolatos géneket az 1990-es években azonosították.
K: Ki kapta meg a 2016-os élettani vagy orvosi Nobel-díjat az autofágiával kapcsolatos munkásságáért?
V: Yoshinori Ohsumi japán kutató kapta a 2016-os élettani vagy orvosi Nobel-díjat az autofágiával kapcsolatos munkájáért.
Keres